Pourquoi nous avons besoin de mieux comprendre la pathophysiologie du COVID Long | Akiko Iwasaki, David Putrino
Les données disponibles montrent que le COVID Long est un syndrome organique post-infection aiguë avec un dysfonctionnement physiologique clair. Il n'est ni productif ni cliniquement ou scientifiquement valide de classer le COVID Long comme une affection psychosomatique.
Akiko Iwasaki est professeure d'immunobiologie et de biologie moléculaire, cellulaire et de biologie du développement à l'université de Yale. Elle est également chercheuse principale à l'Institut médical Howard Hughes.
David Putrino est kinésithérapeute, titulaire d'un doctorat en neurosciences de l'université de Western Australia. Il a commencé sa carrière en tant que clinicien en Australie, puis s'est installé aux États-Unis pour étudier les neurosciences computationnelles à la Harvard Medical School, au MIT et à la NYU.
· Cet article fait partie de notre dossier COVID Long du 21 février 2023 ·
Selon les estimations les plus récentes, plus de 65 millions [1] de personnes vivent avec un état post-COVID-19 (également appelé COVID Long) dans le monde et, en l'absence de diagnostic clair et d'options de traitement, ce nombre ne cesse d'augmenter. Plus de 200 symptômes associés au COVID Long [1] ont été signalés, touchant pratiquement tous les systèmes organiques.
Si certain·es malades se rétablissent, de nombreuses personnes présentent des symptômes depuis début 2020. Cette affection est un diagnostic global qui englobe un ensemble hétérogène de processus physiopathologiques. En tant que tel, plusieurs facteurs peuvent affecter les manifestations du COVID Long, comme la gravité de l'infection aiguë, l'âge, le sexe, les comorbidités préexistantes, la génétique, les facteurs socio-économiques et d'autres facteurs environnementaux. Les personnes ateintes de COVID Long ayant survécu à une infection aiguë grave par le SARS-CoV-2 sont le plus souvent des hommes de plus de 50 ans présentant des lésions tissulaires persistantes et des séquelles. Les personnes ayant un COVID Long après une infection moins sévère sont le plus souvent des femmes plus jeunes (36-50 ans) dont l'infection aiguë a déclenché des réactions physiologiques indésirables.
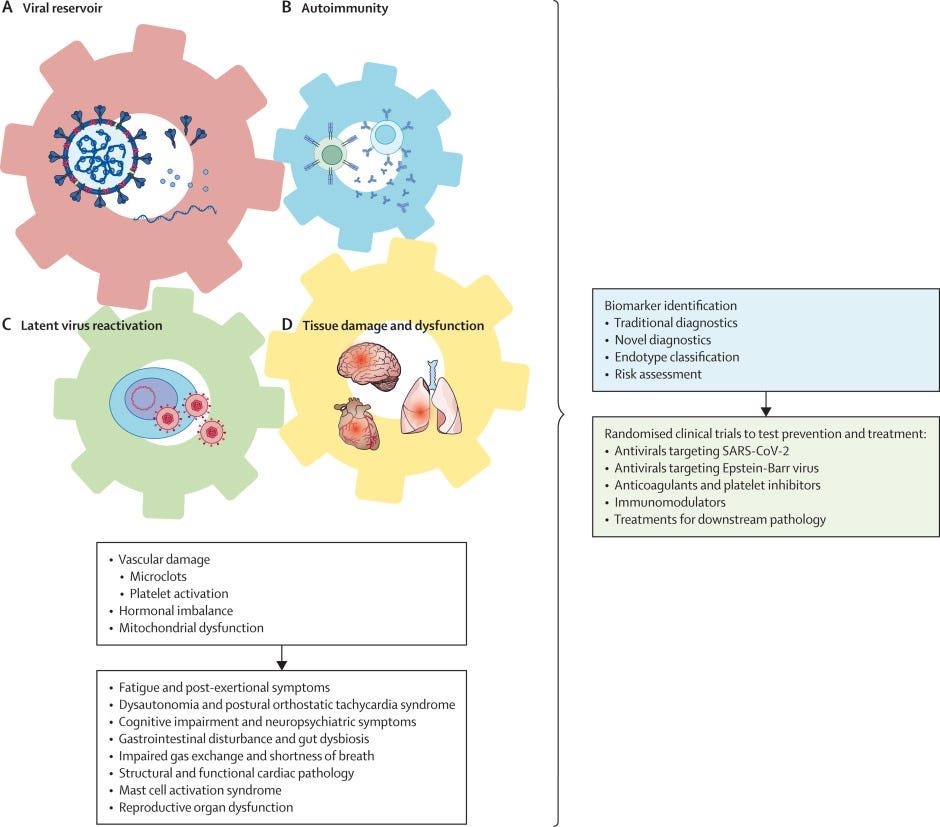
Les principales hypothèses concernant les causes profondes du COVID Long incluent la persistance virale (virus infectieux, ARN viral ou protéines virales), l'auto-immunité déclenchée par l'infection, la réactivation de virus latents et des altérations chroniques déclenchées par l'inflammation qui entraînent un dysfonctionnement et des lésions tissulaires (figure).
Il existe des preuves de plus en plus nombreuses et convaincantes que le SARS-CoV-2 infecte et produit son ARN et ses protéines dans un large éventail de types de cellules dans les tissus, y compris les tissus gastro-intestinaux, respiratoires, cardiovasculaires, lymphoïdes, endocriniens, urogénitaux, oculaires, cutanés, musculaires, le système nerveux périphérique et les tissus du système nerveux central [2]. Des protéines Spike en circulation sont observées chez 60 % des patient·es atteint·es de COVID Long entre 2 et 12 mois après l'infection [3]. Si la présence d'ARN et de protéines virales n'indique pas nécessairement une infection persistante, l'ARN viral peut déclencher des réponses immunitaires innées et les protéines virales pourraient provoquer des lésions tissulaires et stimuler une activation persistante des lymphocytes, entraînant une inflammation chronique.
Chez les personnes avec le COVID Long, l'évaluation des auto-anticorps dirigés contre l'exoprotéome humain à l'aide d'un profilage rapide des antigènes extracellulaires n'a révélé aucune différence significative par rapport aux personnes sans COVID Long [4]. Cependant, les auto-anticorps dirigés contre les antigènes intracellulaires [5] ou les cellules T autoréactives pourraient jouer un rôle dans le COVID Long.
Il existe également des preuves émergentes de la réactivation d'herpèsvirus latents chez les personnes atteintes de COVID Long. La réactivation de virus d'Epstein-Barr latent, mais pas d’infection aiguë par la mononucléose, est constatée chez les personnes avec le COVID Long [4,6], et la virémie du virus d'Epstein-Barr au moment de la COVID aiguë est prédictive de COVID Long [5].
Une réponse inflammatoire locale au SARS-CoV-2 dans un organe peut provoquer des altérations durables dans des tissus et organes distants. Dans un modèle chez des souris, on a constaté que même un COVID-19 bénin limité aux poumons (dans lequel le virus infectieux est devenu indétectable en une semaine) induisait des changements prolongés dans le système nerveux central, notamment une activation microgliale, une perte d'oligodendrocytes et une myélinisation réduite, jusqu'à 7 semaines après l'infection [7].
Au-delà de ces causes profondes potentielles, de nombreux changements pathologiques secondaires ont été observés chez les personnes avec le COVID Long, notamment la formation de microcaillots et l'activation des plaquettes [8], la réduction du cortisol [4,5] et le dysfonctionnement mitochondrial [9].
Malgré la pathogénie multifactorielle, les données disponibles montrent que le COVID Long est un syndrome organique post-infection aiguë (PAIS) avec un dysfonctionnement physiologique clair qui, souvent, n'est pas systématiquement apparent à l'aide des tests de diagnostic médicaux standards. Cette particularité souligne la nécessité d'une nouvelle génération de procédures de test plus sensibles pour les personnes atteintes de PAIS. Nous ignorons si des diagnostics psychologiques préexistants pourraient influencer le risque de COVID Long (par exemple, en affectant les systèmes endocrinien et immunitaire de l'hôte), il n'est ni productif ni cliniquement ou scientifiquement valide de classer le COVID Long comme une affection psychosomatique.
Comme il devient de plus en plus difficile d'éviter le COVID-19, nous soutenons que des analyses biologiques approfondies permettront d'identifier des biomarqueurs pour le COVID Long et éventuellement d'identifier des endotypes distincts induits par différentes causes profondes, de sorte que le risque lié au COVID Long soit mieux défini. L'identification des biomarqueurs sera non seulement cruciale pour identifier les facteurs de prédisposition, mais elle nous permettra également de mettre en œuvre des politiques plus sûres et fondées sur des preuves. De même, les analyses moléculaires, cellulaires et physiologiques permettront d'élaborer des interventions de précision ciblant les causes profondes de chaque endotype de COVID Long. Par exemple, une infection virale persistante pourrait être ciblée par des antiviraux ; le COVID Long engendré par une maladie auto-immune pourrait être traité à l'aide d'anticorps monoclonaux qui ciblent les lymphocytes ou de médicaments qui bloquent les cytokines et la signalisation des cytokines ; et, si la réactivation des herpèsvirus contribue à la maladie, on pourrait envisager de cibler ces virus à l'aide d'antiviraux ou de vaccins. Les critères de diagnostic tenant compte des causes profondes pour prévenir et traiter le COVID Long nécessiteront de vastes études longitudinales. Si le ciblage thérapeutique des causes profondes n'est pas réalisable, les conséquences pathologiques en aval de la COVID Long pourraient néanmoins être traitées.
Idéalement, les thérapies potentielles devraient être évaluées dans le cadre d'essais cliniques en double aveugle, contrôlés par placebo et randomisés. Cependant, de telles études sont assez coûteuses, demandent beaucoup de travail et nécessitent un soutien important de la part des gouvernements, des organismes de réglementation et de l'industrie.
Les syndromes comme le COVID Long ne sont pas nouveaux. D'autres PAIS, telles que l'encéphalomyélite myalgique, le syndrome de fatigue chronique et le syndrome de la maladie de Lyme après traitement, présentent des symptômes similaires à ceux du COVID Long [10]. Ainsi, l'inclusion de personnes atteintes d'autres formes de PAIS en tant que groupes de comparaison dans la recherche sur le COVID Long est importante pour élargir la compréhension globale et l'impact de cette recherche. Enfin, les connaissances actuelles sur le COVID Long ne seraient pas possibles sans le travail acharné et le dévouement des communautés de patient·es qui s'efforcent de trouver des réponses.
Publication originale (14/02/2023) :
The Lancet
· Cet article fait partie de notre dossier COVID Long du 21 février 2023 ·
Références
1. Davis HE, McCorkell L, Vogel JM, Topol EJ. Long COVID: major findings, mechanisms and recommendations. Nat Rev Microbiol 2023; published online Jan 13. https://doi.org/10.1038/s41579-022-00846-2.
2. Stein SR, Ramelli SC, Grazioli A, et al. SARS-CoV-2 infection and persistence in the human body and brain at autopsy. Nature 2022; 612: 758–63.
3. Swank Z, Senussi Y, Manickas-Hill Z, et al. Persistent circulating SARS-CoV-2 spike is associated with post-acute COVID-19 sequelae. Clin Infect Dis 2022; published online Sept 2. https://doi.org/101.093/cid/ciac722.
4. Klein J, Wood J, Jaycox J, et al. Distinguishing features of long COVID identified through immune profiling. medRxiv 2022; published online Aug 10. https://doi.org/101.101/20220.80.92.2278592 (preprint).
5. Su Y, Yuan D, Chen DG, et al. Multiple early factors anticipate post-acute COVID-19 sequelae. Cell 2022; 185: 881–95.
6. Peluso MJ, Deveau TM, Munter SE, et al. Chronic viral coinfections differentially affect the likelihood of developing long COVID. J Clin Invest 2023; published online Feb 1. https://doi.org/10.1172%2FJCI163669.
7. Fernández-Castañeda A, Lu P, Geraghty AC, et al. Mild respiratory COVID can cause multi-lineage neural cell and myelin dysregulation. Cell 2022; 185: 2452–2468.e16.
8. Pretorius E, Venter C, Laubscher GJ, et al. Prevalence of symptoms, comorbidities, fibrin amyloid microclots and platelet pathology in individuals with long COVID/post-acute sequelae of COVID-19 (PASC). Cardiovasc Diabetol 2022; 21: 148.
9. Guntur VP, Nemkov T, de Boer E, et al. Signatures of mitochondrial dysfunction and impaired fatty acid metabolism in plasma of patients with post-acute sequelae of COVID-19 (PASC). Metabolites 2022; 12: 1026.
10. Choutka J, Jansari V, Hornig M, Iwasaki A. Unexplained post-acute infection syndromes. Nat Med 2022; 28: 911–23