COVID Long : principaux résultats, mécanismes et recommandations | Hannah E. Davis, Lisa McCorkell, Julia Moore Vogel & Eric J. Topol
Dans cette Revue, nous explorons la base des connaissances actuelle sur le COVID Long ainsi que les idées fausses qui entourent le COVID Long et les domaines dans lesquels des recherches supplémentaires sont nécessaires.
Hannah E. Davis, Patient-Led Research Collaborative, New York, NY, USA
Lisa McCorkell, Patient-Led Research Collaborative, Oakland, CA, USA
Julia Moore Vogel & Eric J. Topol, Scripps Research Translational Institute, Scripps Research, La Jolla, CA, USA
· Cet article fait partie de notre dossier COVID Long du 21 février 2023 ·
Résumé
Le COVID long est une maladie souvent invalidante qui survient dans au moins 10% des cas d'infection par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2). Plus de 200 symptômes ont été identifiés, avec des impacts sur de multiples systèmes organiques. On estime qu'au moins 65 millions de personnes dans le monde sont atteintes du COVID Long, et le nombre de cas augmente chaque jour. La recherche biomédicale a fait des progrès substantiels dans l'identification de divers changements physiopathologiques et facteurs de risque et dans la caractérisation de la maladie. De plus, les similitudes avec d'autres maladies d'origine virale telles que l'encéphalomyélite myalgique/syndrome de fatigue chronique (EM/SFC) et le syndrome de tachycardie orthostatique posturale (POTS) ont préparé le terrain pour la recherche dans ce domaine. Dans cette Revue, nous explorons la littérature actuelle et en dégageons les principales conclusions, le chevauchement avec d'autres affections, l'apparition variable des symptômes, le COVID Long chez les enfants et l'impact des vaccinations. Bien que ces résultats clés soient essentiels à la compréhension du COVID Long, les options de diagnostic et de traitement actuelles sont insuffisantes, et il faut donner la priorité aux essais cliniques qui se penchent sur les principales hypothèses. En outre, pour renforcer la recherche sur le COVID Long, les études futures doivent tenir compte des biais et des problèmes liés aux tests de dépistage du SRAS-CoV-2, inclure les populations marginalisées et faire participer les patient·es de manière significative tout au long du processus de recherche.
Introduction
Le COVID Long (parfois appelé "syndrome post-COVID") est une affection multisystémique comprenant des symptômes souvent graves qui font suite à une infection par le coronavirus 2 responsable d'un syndrome respiratoire aigu sévère (SRAS-CoV-2). Au moins 65 millions d'individus dans le monde ont des séquelles de COVID, sur la base d'une incidence estimée de manière modérée à 10 % des personnes infectées et de plus de 651 millions de cas documentés de COVID-19 dans le monde [1] ; ce nombre est probablement beaucoup plus élevé en raison de nombreux cas non documentés. L'incidence est estimée entre 10-30% des cas non hospitalisés, 50-70% des cas hospitalisés [2,3] et 10-12% des cas vaccinés [4,5]. Le COVID Long est associé à tous les âges et à toutes les sévérités de la maladie en phase aiguë, le pourcentage le plus élevé de diagnostics se situant entre 36 et 50 ans. La plupart des cas de COVID Long concernent des patient·es non hospitalisé·es ayant souffert d'une maladie aiguë légère [6], cette population représentant la majorité des cas globaux de COVID-19. Il existe de nombreux enjeux de recherche, comme le souligne cette revue, et de nombreuses questions ouvertes, notamment en ce qui concerne la physiopathologie, les traitements efficaces et les facteurs de risque.
Des centaines de résultats biomédicaux ont été documentés, avec de nombreux·ses patient·es présentant des dizaines de symptômes dans plusieurs systèmes organiques [7] (Fig. 1). Le COVID Long regroupe de multiples manifestations indésirables, les nouvelles affections les plus courantes étant les maladies cardiovasculaires, thrombotiques et cérébrovasculaires [8], le diabète de type 2 [9], l'encéphalomyélite myalgique/syndrome de fatigue chronique (ME/CFS) [10,11] et la dysautonomie, en particulier le syndrome de tachycardie orthostatique posturale (POTS) [12] (Fig. 2). Les symptômes peuvent durer des années [13] et, en particulier dans les cas d'EM/SFC nouvellement apparus et de dysautonomie, on peut s'attendre à ce qu'ils durent toute la vie [14]. Une proportion importante des personnes souffrant d'un COVID Long étant incapable de retourner au travail [7], l'ampleur du nombre de personnes nouvellement handicapées contribue à la pénurie de main-d'œuvre [15]. Il n'existe actuellement aucun traitement efficace validé.
Fig 1 : Symptômes du COVID Long et impacts sur de nombreux organes avec des pathologies diverses.
Les impacts du COVID Long sur de nombreux organes avec une grande variété de pathologie sont montrés. La présentation des pathologies se chevauche souvent, ce qui peut exacerber les difficultés de prise en charge. SAMA, syndrome d'activation des mastocytes ; EM/SFC, encéphalomyélite myalgique/syndrome de fatigue chronique ; POTS, syndrome de tachycardie orthostatique posturale.
Fig 2 : L'infection par le SRAS-CoV-2, le COVID-19 et le COVID Long augmentent les risques de plusieurs affections médicales.
Étant donné que les données spécifiques au diagnostic sur de grandes populations présentant un COVID Long sont rares, les résultats des infections générales sont inclus et une grande proportion de complications médicales devrait résulter d'un COVID Long, bien que la proportion précise ne puisse être déterminée. Un an après l'infection initiale, les infections par le SRAS-CoV-2 augmentent le risque d'arrêt cardiaque, de décès, de diabète, d'insuffisance cardiaque, d'embolie pulmonaire et d'accident vasculaire cérébral, comme l'a montré l'étude réalisée à partir des bases de données du ministère américain des anciens combattants. En outre, il existe un risque clairement accru de développer une encéphalomyélite myalgique/syndrome de fatigue chronique (ME/CFS) et une dysautonomie. Six mois après la contamination, on a observé dans la même cohorte des risques accrus de troubles cardiovasculaires, de troubles de la coagulation et de troubles hématologiques, de décès, de fatigue, de troubles neurologiques et de troubles pulmonaires. Le rapport de risque est le rapport entre la fréquence de survenue d'un événement dans un groupe par rapport à un autre ; dans ce cas, les personnes qui ont eu le COVID-19 par rapport à celles qui ne l'ont pas eu. Les sources de données sont les suivantes : diabète [9], conséquences cardiovasculaires [8], dysautonomie [8,201], EM/SFC [10,202] et nouvelles infections [4].
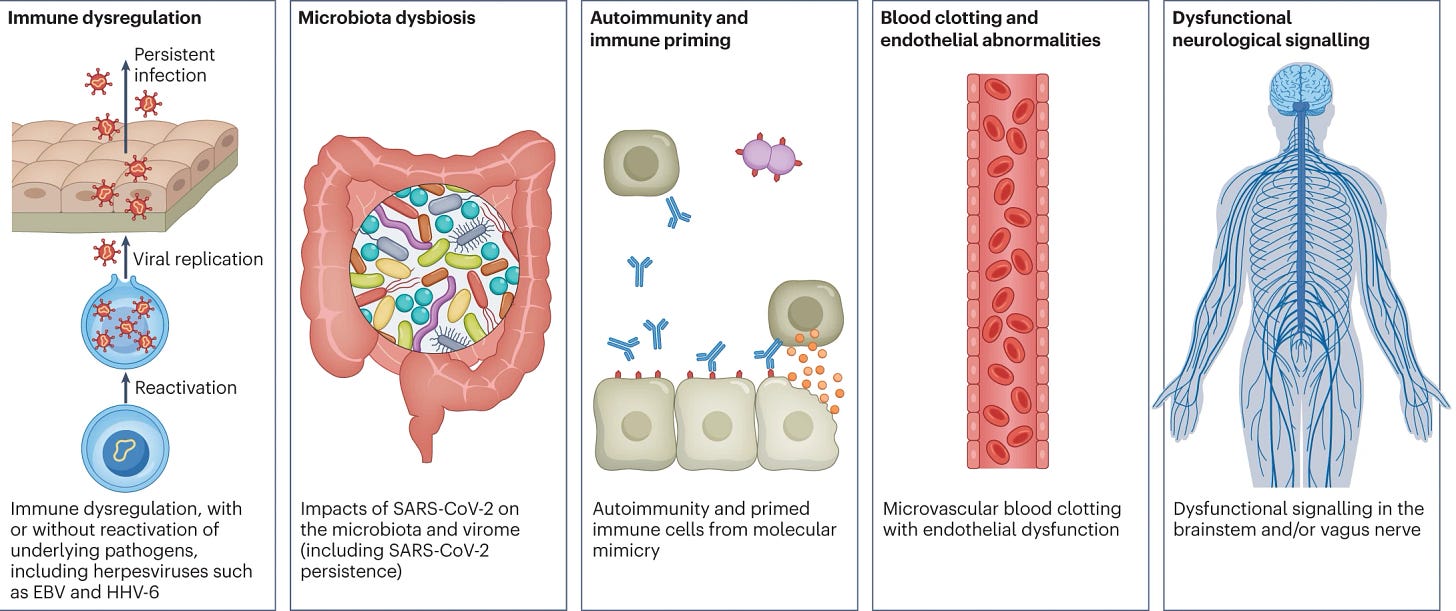
Les causes du COVID Long sont probablement multiples et peuvent se chevaucher. Plusieurs hypothèses pour sa pathogenèse ont été suggérées, notamment des réservoirs persistants de SRAS-CoV-2 dans les tissus [16,17] ; un dérèglement immunitaire [17,18,19,20] avec ou sans réactivation d'agents pathogènes sous-jacents, y compris des herpèsvirus comme le virus d'Epstein-Barr (EBV) et l'herpèsvirus humain 6 (HHV-6) entre autres [17,18,21,22] ; les répercussions du SRAS-CoV-2 sur le microbiote, y compris le virome [17,23,24,25] ; l'auto-immunité [17,26,27,28] et l'amorçage du système immunitaire par mimétisme moléculaire [17] ; la coagulation sanguine microvasculaire avec dysfonctionnement endothélial [17,29,30,31] ; et la signalisation dysfonctionnelle dans le tronc cérébral et/ou le nerf vague [17,32] (figure 3). Les études sur les mécanismes en sont généralement à un stade précoce, et bien que des travaux s'appuyant sur les recherches existantes sur les maladies post-virales telles que l'EM/SFC aient fait progresser certaines théories, de nombreuses questions demeurent et doivent être traitées en priorité. Les facteurs de risque potentiels incluent le sexe féminin, le diabète de type 2, la réactivation de l'EBV, la présence d'auto-anticorps spécifiques [27], les troubles du tissu conjonctif [33], le trouble déficitaire de l'attention avec hyperactivité, l'urticaire chronique et la rhinite allergique [34], bien qu'un tiers des personnes atteintes de COVID Long ne présentent aucune condition préexistante identifiée [6]. Une prévalence plus élevée de COVID Long a été signalée dans certaines groupes ethniques, notamment chez les personnes d'origine hispanique ou latinx [35]. Les facteurs de risque socio-économiques comprennent un revenu plus faible et une incapacité à se reposer de manière adéquate dans les premières semaines suivant l'apparition du COVID-19 (réf. 36,37). Avant l'émergence du SRAS-CoV-2, de multiples infections virales et bactériennes étaient connues pour provoquer des maladies post-infectieuses telles que l'EM/SFC [17,38], et il semble que le COVID Long partage leurs caractéristiques mécanistiques et phénotypiques [17,39]. De plus, la dysautonomie a été observée dans d'autres maladies post-virales et est fréquemment observée dans le COVID Long [7].
Fig. 3 : Mécanismes hypothétiques de la pathogenèse du COVID Long.
Il existe plusieurs mécanismes hypothétiques pour la pathogenèse du COVID Long, y compris la dérégulation immunitaire, la perturbation du microbiote, l'auto-immunité, la coagulation et l'anomalie endothéliale, et la signalisation neurologique dysfonctionnelle. EBV, virus d'Epstein-Barr ; HHV-6, herpèsvirus humain 6 ; SARS-CoV-2, coronavirus 2 du syndrome respiratoire aigu sévère.
Dans cette Revue, nous explorons la base des connaissances actuelle sur le COVID Long ainsi que les idées fausses qui entourent le COVID Long et les domaines dans lesquels des recherches supplémentaires sont nécessaires. Étant donné que la plupart des patient·es atteint·es de COVID Long n'ont pas été hospitalisé·es pour leur infection initiale par le SRAS-CoV-2 [6], nous nous concentrons sur les recherches qui incluent des patient·es atteint·es de COVID-19 aiguë légèr (c'est-à-dire non hospitalisé·es et sans signe d'affection respiratoire). La plupart des études dont nous parlons concernent des adultes, à l'exception de celles de l'encadré 1.
Encadré 1 : Le COVID Long chez les enfants
Le COVID Long a un impact sur les enfants de tous âges. Une étude a montré que la fatigue, les maux de tête, les vertiges, la dyspnée, les douleurs thoraciques, la dysosmie, la dysgueusie, la réduction de l'appétit, les difficultés de concentration, les problèmes de mémoire, l'épuisement mental, l'épuisement physique et les problèmes de sommeil étaient entre 2 et 36 fois plus probables chez les personnes atteintes de COVID Long âgées de 15 à 19 ans que chez les témoins du même âge [203]. Une étude nationale menée au Danemark comparant des enfants ayant un résultat positif à un test PCR à des sujets témoins a montré que les premiers avaient plus de chances de déclarer au moins un symptôme durant plus de 2 mois [204]. Comme les adultes atteints de COVID Long, les enfants atteints de COVID Long souffrent de fatigue, de malaise post-effort, de dysfonctionnement cognitif, de perte de mémoire, de maux de tête, d'intolérance orthostatique, de troubles du sommeil et d'essoufflement [204,205]. Des lésions hépatiques ont été enregistrées chez des enfants qui n'ont pas été hospitalisés lors d'infections aiguës par le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) [206], et bien que rares, les enfants qui ont eu le COVID-19 présentent des risques accrus d'embolie pulmonaire aiguë, de myocardite et de cardiomyopathie, d'événements thromboemboliques veineux, d'insuffisance rénale aiguë et non spécifiée et de diabète de type 1 [207]. Les nourrissons nés de personnes ayant eu le COVID-19 pendant la grossesse étaient plus susceptibles de recevoir un diagnostic de troubles neurodéveloppementaux au cours de la première année suivant l'accouchement [208]. L'expérience du traitement des patients d'un centre pédiatrique de COVID Long indique que les adolescents atteints d'une forme modérée à sévère de COVID Long présentent des caractéristiques compatibles avec l'encéphalomyélite myalgique/syndrome de fatigue chronique[205]. Les enfants atteints de COVID Long présentent un hypométabolisme cérébral similaire à celui observé chez les adultes atteints de COVID Long209. Un dysfonctionnement pulmonaire à long terme est constaté chez les enfants atteints de COVID Long et ceux qui se sont rétablis du COVID-19 [210]. Les enfants atteints de COVID Long étaient plus susceptibles de souffrir de troubles de l'attention avec hyperactivité, d'urticaire chronique et de rhinite allergique avant d'être infectés [34].
Des recherches supplémentaires sur le COVID Long chez les enfants sont nécessaires, bien qu'il soit difficile d'assurer un groupe de contrôle adéquat en raison des problèmes de test. Plusieurs études ont constaté que les enfants infectés par le SRAS-CoV-2 sont beaucoup moins susceptibles d'avoir un résultat positif au test PCR que les adultes, malgré une séroconversion des semaines plus tard, et que jusqu'à 90 % des cas sont manqués [189,190]. De plus, les enfants sont beaucoup moins susceptibles de se séroconvertir et, s'ils développent des anticorps, ils sont plus susceptibles d'avoir une réponse qui s'affaiblit dans les mois qui suivent l'infection par rapport aux adultes [193].
Principaux résultats
Immunologie et virologie
Les études portant sur la dysrégulation immunitaire chez les personnes atteintes de COVID Long qui ont eu un COVID-19 aiguë léger ont trouvé des altérations des cellules T (ou lymphocytes T), y compris des cellules T épuisées [18], un nombre réduit de cellules mémoires effectrices CD4+ et CD8+18,19 et une expression élevée de PD1 sur les cellules mémoires centrales, persistant pendant au moins 13 mois [19]. Des études ont également fait état de cellules immunitaires innées hautement activées, d'une carence en cellules T et B naïves et d'une expression élevée des interférons de type I et de type III (interféron-β (IFNβ) et IFNλ1), persistant pendant au moins 8 mois [20]. Une étude exhaustive comparant des patient·es atteint·es de COVID Long à des personnes non infectées et à des personnes infectées sans COVID Long a révélé une augmentation du nombre de monocytes non classiques, de cellules B activées, de cellules B doublement négatives et de cellules T CD4+ sécrétant de l'IL-4 et de l'IL-6, ainsi qu'une diminution du nombre de cellules dendritiques classiques et de cellules T épuisées et un faible taux de cortisol chez les personnes atteintes de COVID Long, 14 mois en moyenne après l'infection [18]. On a constaté que l'accroisement des cellules T cytotoxiques était associée à la manifestation gastro-intestinale du COVID Long [27]. D'autres études ont trouvé des niveaux élevés de cytokines, en particulier IL-1β, IL-6, TNF et IP10 [40,41], et un récent préprint a rapporté une élévation persistante du niveau de CCL11, qui est associé à un dysfonctionnement cognitif [42]. Il reste à voir si le schéma des cytokines dans l'EM/SFC, où les niveaux de certaines cytokines sont élevés dans les 2-3 premières années de la maladie mais diminuent au fil du temps sans une diminution correspondante des symptômes [43], est similaire dans le COVID Long.
De multiples études ont trouvé des niveaux élevés d'auto-anticorps dans les COVID Longs [27], y compris des auto-anticorps dirigés contre l'ACE2 [28] (le récepteur d'entrée du SRAS-CoV-2), le β2-adrénocepteur, le récepteur muscarinique M2, le récepteur AT1 de l'angiotensine II et le récepteur MAS de l'angiotensine 1-726. Des niveaux élevés d'autres auto-anticorps ont été trouvés chez certain·es patient·es atteint·es de COVID-19 de manière plus générale, y compris des auto-anticorps qui ciblent les tissus (comme le tissu conjonctif, les composants de la matrice extracellulaire, l'endothélium vasculaire, les facteurs de coagulation et les plaquettes), les systèmes organiques (y compris le poumon, le système nerveux central, la peau et le tractus gastro-intestinal), les protéines immunomodulatrices (cytokines, chimiokines, composants de complément et protéines de surface cellulaire) [44]. Une importante étude exhaustive n'a toutefois pas trouvé que les auto-anticorps étaient une composante majeure du COVID Long [18].
Des virus réactivés, dont l'EBV et le HHV-6, ont été trouvés chez des patient·es atteint·es de COVID Long [18,21,22,27] (et ont été identifiés dans l'EM/SFC45), et entraînent une fragmentation mitochondriale et affectent gravement le métabolisme énergétique [46]. Un récent préprint a rapporté que la réactivation de l'EBV est associée à la fatigue et au dysfonctionnement neurocognitif chez les patient·es atteint·es de COVID Long [22].
Plusieurs études ont montré qu'une production faible ou nulle d'anticorps anti-SRAS-CoV-2 et d'autres réponses immunitaires insuffisantes au cours de la phase aiguë de la COVID-19 étaient prédictives d'un COVID Long à 6-7 mois, tant chez les patient·es hospitalisé·es que chez les patient·es non hospitalisé·es [47,48]. Ces réponses immunitaires insuffisantes comprennent un faible niveau de base d'IgG [48], de faibles niveaux de RBD (Receptor-Binding Domain, domaine de liaison au recepteur) et de cellules B mémoire spécifiques de spike, de faibles niveaux d'IgG de la nucléocapside [49] et de faibles pics d'IgG spécifiques de spike [47]. Dans un récent préprint, des réponses faibles ou absentes des cellules T CD4+ et des cellules T CD8+ ont été notées chez les patient·es atteint·es de COVID Long sévère [49], et une étude distincte a trouvé des niveaux plus faibles de cellules T CD8+ exprimant CD107a et un déclin des cellules T CD8+ produisant l'interféron-γ spécifique du nucléocapside chez les patient·es atteint·es de COVID Long par rapport aux témoins infecté·es n'ayant pas développé de COVID Long [50]. On a constaté que les niveaux élevés d'auto-anticorps dans les COVID Longs sont inversement corrélés aux anticorps protecteurs du COVID-19, ce qui semble indiquer que les patient·es présentant des niveaux élevés d'auto-anticorps sont plus susceptibles de contracté des nouvelles infections [27]. Le rebond viral du SRAS-CoV-2 dans l'intestin, résultant peut-être de la persistance virale, a également été associé à des niveaux plus faibles et à une production plus lente d'anticorps IgA et IgG du domaine de liaison au récepteur (RBD) [51]. Il existe des différences majeures dans la création d'anticorps, la séroconversion et les taux d'anticorps entre les sexes, les femmes étant moins susceptibles de se séroconvertir, étant plus susceptibles de se séro-révertir et ayant des taux d'anticorps plus faibles dans l'ensemble [52,53], affectant même le déclin des anticorps après la vaccination [54].
Plusieurs rapports ont mis en évidence une possible persistance virale comme moteur des symptômes du COVID Long ; des protéines et/ou de l'ARN viraux ont été trouvés dans l'appareil reproducteur, l'appareil cardiovasculaire, le cerveau, les muscles, les yeux, les ganglions lymphatiques, l'appendice, les tissus mammaires, les tissus hépatiques, les tissus pulmonaires, le plasma, les selles et l'urine [55,56,57,58,59,60]. Dans une étude, l'antigène spike circulant du SRAS-CoV-2 a été trouvé chez 60 % d'une cohorte de 37 patient·es atteint·es de COVID Long jusqu'à 12 mois après le diagnostic, contre 0 % des 26 personnes infectées par le SRAS-CoV-2, ce qui implique probablement un réservoir de virus actif ou de composants du virus [16]. En effet, de multiples rapports faisant suite à des biopsies gastro-intestinales ont indiqué la présence du virus, ce qui suggère un réservoir persistant chez certain·es patient·es [58,61].
Problèmes vasculaires et lésions organiques
Bien que le COVID-19 ait été initialement reconnu comme une maladie respiratoire, le SRAS-CoV-2 est capable d'endommager de nombreux systèmes organiques. Les lésions observées dans divers tissus ont été principalement attribuées à une réponse à médiation immunitaire et à une inflammation, plutôt qu'à une infection directe des cellules par le virus. Les perturbations du système circulatoire comprennent une dysfonction endothéliale et des effets ultérieurs en aval, ainsi que des risques accrus de thrombose veineuse profonde, d'embolie pulmonaire et d'hémorragie [29,30,62]. Les microcaillots détectés dans le COVID-19 aigu et le COVID Long contribuent aux thromboses [63] et constituent une cible diagnostique et thérapeutique intéressante. Des modifications à long terme de la taille et de la rigidité des cellules sanguines ont également été constatées dans le COVID Long, pouvant potentiellement affecter l'apport en oxygène [64]. Une réduction durable de la densité vasculaire, affectant spécifiquement les petits capillaires, a été constatée chez les patient·es atteint·es de COVID Long par rapport aux témoins, 18 mois après l'infection [65]. Une étude ayant trouvé des niveaux élevés de biomarqueurs sanguins de transformation vasculaire chez les patient·es atteint·es de COVID Long a également révélé que les marqueurs d'angiogenèse ANG1 et P-sélectine avaient tous deux une sensibilité et une spécificité élevées pour prédire le statut de COVID Long [66].
Une analyse des bases de données du ministère américain des Ancien·nes combattant·es (données VA, Veterans Affairs databases) incluant plus de 150 000 personnes un an après l'infection par le SRAS-CoV-2 a indiqué un risque significativement accru de diverses maladies cardiovasculaires, dont l'insuffisance cardiaque, les dysrythmies et les accidents vasculaires cérébraux, indépendamment de la gravité de la présentation initiale du COVID-19 [8] (Fig. 2). Des études d'IRM cardiaque ont révélé une atteinte cardiaque chez 78 % des 100 personnes ayant déjà présenté un épisode de COVID-19 (étudiées en moyenne 71 jours après l'infection [67]) et chez 58 % des participant·es ayant présenté un COVID Long (étudiés 12 mois après l'infection [68]), ce qui renforce la durabilité des anomalies cardiaques.
De multiples études ont révélé des dommages à plusieurs organes associés au COVID-19. Une étude prospective menée sur des personnes à faible risque, portant sur le cœur, les poumons, le foie, les reins, le pancréas et la rate, a noté que 70 % des 201 patient·es présentaient des lésions à au moins un organe et 29 % des dommages à plusieurs organes [69]. Dans une étude de suivi d'un an, menée par le même groupe de recherche portant sur 536 participant·es, les auteur·ices de l'étude ont constaté que 59 % avaient des lésions à un seul organe et 27 % à plusieurs organes [70]. Une étude consacrée aux reins à partir des données VA, incluant plus de 89 000 personnes ayant eu un COVID-19, a noté un risque accru de nombreux effets néfastes sur les reins [71]. Une autre analyse des données VA, incluant plus de 181 000 personnes ayant eu un COVID-19, a révélé que l'infection augmente également le risque de diabète de type 2 9 (Fig. 2). Les lésions organiques présentes chez les patient·es ayant un COVID Long semblent durables, et les effets à plus long terme restent inconnus.
Systèmes neurologique et cognitif
Les symptômes neurologiques et cognitifs sont une caractéristique majeure des COVID Longs, notamment les symptômes sensorimoteurs, les pertes de mémoire, les troubles cognitifs, la paresthésie, les vertiges et les problèmes d'équilibre, la sensibilité à la lumière et au bruit, la perte (ou la présence fantôme) de l'odorat ou du goût, et la dystonie neurovégétative (dysautonomie), qui ont souvent un impact sur les activités de la vie quotidienne [7,32]. Les manifestations audiovestibulaires du COVID Long comprennent les acouphènes, la perte d'audition et les vertiges [7,72].
Dans une méta-analyse, une forte fatigue a été constatée chez 32% et des troubles cognitifs chez 22% des patient·es atteint·es de COVID-19 à 12 semaines après l'infection [3]. Les déficiences cognitives dans le COVID Long sont débilitantes, de la même ampleur que l'intoxication correspondant au seuil de la conduite en état d'ivresse au Royaume-Uni ou à 10 ans de vieillissement cognitif [73], et peuvent augmenter avec le temps, une étude ayant constaté leur apparition chez 16 % des patients 2 mois après l'infection et 26 % des patients 12 mois après l'infection [74]. L'activation de la voie de la kynurénine, en particulier la présence des métabolites que sont l'acide quinolinique, l'acide 3-hydroxyanthranilique et la kynurénine, a été identifiée dans le COVID Long, et est associée à des troubles cognitifs [74]. Des troubles cognitifs ont également été constatés chez des personnes qui se sont rétablies du COVID-19 [75], et à des taux plus élevés lorsque des mesures objectives par rapport à des mesures subjectives étaient utilisées [3], ce qui suggère qu'un sous-ensemble de personnes souffrant de troubles cognitifs peuvent ne pas reconnaître et/ou signaler leurs troubles. La déficience cognitive est une caractéristique qui se manifeste indépendamment de conditions de santé mentale telles que l'anxiété et la dépression [74,76], et se produit à des taux similaires chez les patient·es hospitalisé·es et non hospitalisé·es [74,76]. Un rapport portant sur plus de 1,3 million de personnes ayant eu le COVID-19 a montré que les problèmes de santé mentale telles que l'anxiété et la dépression sont revenues à la normale avec le temps, mais que les risques accrus de déficience cognitive (brouillard cérébral), de crises, de démence, de psychose et d'autres conditions neurocognitives ont persisté pendant au moins 2 ans [77].
Les mécanismes possibles de ces neuropathologies comprennent la neuroinflammation, les dommages causés aux vaisseaux sanguins par la coagulopathie et le dysfonctionnement endothélial, et les lésions des neurones [32]. Des études ont mis en évidence des signaux similaires à ceux de la maladie d'Alzheimer chez les patient·es atteint·es de COVID Long [78], des peptides qui s'auto-assemblent en amyloïdes toxiques pour les neurones [79], une neuroinflammation généralisée [80], un hypométabolisme du cerveau et du tronc cérébral corrélé à des symptômes spécifiques [81,82] et des anomalies du liquide céphalo-rachidien chez des personnes non hospitalisées atteintes de COVID Long, ainsi qu'une association entre un âge plus jeune et un retard dans l'apparition des symptômes neurologiques [83]. Un récent préprint fait état d'un dérèglement cellulaire multiligne et d'une perte de myéline chez des patient·es atteint·es de COVID Long suite à une infection légère, avec une réactivité microgliale similaire à celle observée en cas de chimiothérapie, connue sous le nom de "chemobrain" [42]. Une étude de la UK Biobank, incluant l'imagerie cérébrale chez les mêmes patient·es avant et après le COVID-19 ainsi que chez des individus témoins, a montré une réduction de l'épaisseur de la matière grise dans le cortex orbitofrontal et le gyrus parahippocampique (marqueurs de dommages tissulaires dans les zones connectées au cortex olfactif primaire), une réduction globale de la taille du cerveau et un déclin cognitif plus important chez les patient·es après le COVID-19 par rapport aux témoins, même chez les patient·es non hospitalisé·es. Bien que cette étude ait porté sur des individus atteints de COVID-19 par rapport à des témoins, et non spécifiquement de COVID Long, elle pourrait avoir une implication dans la composante cognitive du COVID Long84. Des niveaux anormaux de protéines mitochondriales ainsi que de protéines de pointe et de nucléocapside du SRAS-CoV-2 ont été trouvés dans le système nerveux central [85]. Des déficiences en tétrahydrobioptérine et un stress oxydatif sont également observés dans les cas de COVID Long [86].
Dans les yeux, on a constaté une perte de petites fibres nerveuses cornéennes et une augmentation de la densité des cellules dendritiques dans les cas de COVID Longs [87,88], ainsi qu'une altération significative des réponses pupillaires à la lumière [89] et une altération de la microcirculation rétinienne [90]. Le SRAS-CoV-2 peut infecter et se répliquer dans les organoïdes de la rétine [59] et du cerveau [91]. Parmi les autres manifestations du COVID Long figurent les hémorragies rétiniennes, des taches de coton et l'occlusion des veines rétiniennes [92].
Des modèles sur des souris d'infection légère par le SRAS-CoV-2 ont montré une réactivité microgliale et des niveaux élevés de CCL11, qui sont associés à un dysfonctionnement cognitif et à une altération de la neurogenèse [42]. Les modèles sur des hamsters présentaient un état inflammatoire continu, impliquant une activation des cellules T et des myéloïdes, la production de cytokines pro-inflammatoires et une réponse interféron qui était corrélée à des comportements de type anxiété et dépression chez les hamsters, avec des signatures transcriptionnelles similaires trouvées dans les tissus des humains qui s'étaient rétablis du COVID-19 (réf. 93). Les primates non humains infectés présentant une infection légère ont montré une neuroinflammation, des lésions neuronales et une apoptose, des microhémorragies cérébrales, ainsi qu'une hypoxémie chronique et une hypoxie cérébrale [94].
Des rapports récents indiquent de faibles niveaux de cortisol sanguin chez les patients souffrant de COVID Long par rapport aux individus témoins, plus d'un an après la durée des symptômes [18,27]. La faible production de cortisol par la glande surrénale devrait être compensée par une augmentation de la production d'hormone adrénocorticotrope (ACTH) par l'hypophyse, mais ce n'est pas le cas, ce qui confirme le dysfonctionnement de l'axe hypothalamus-hypophyse-surrénale [18]. Cela peut également refléter un processus neuroinflammatoire sous-jacent. De faibles niveaux de cortisol ont déjà été documentés chez les personnes atteintes d'EM/SFC.
EM/SFC, dysautonomie et troubles associés
L'EM/SFC est une maladie neuro-immune multisystémique dont l'apparition fait souvent suite à une infection virale ou bactérienne. Les critères incluent une "réduction ou une altération substantielle de la capacité à s'engager dans les activités professionnelles, éducatives, sociales ou personnelles du niveau antérieur à la maladie" pendant au moins 6 mois, accompagnée d'une fatigue profonde qui n'est pas soulagée par le repos, ainsi que d'un malaise post-effort, d'un sommeil non réparateur et d'une altération cognitive ou d'une intolérance orthostatique (ou les deux) [95]. Jusqu'à 75 % des personnes atteintes d'EM/SFC ne peuvent pas travailler à temps plein et 25 % ont une EM/SFC grave, ce qui signifie souvent qu'elles sont alitées, qu'elles ont une sensibilité extrême aux stimuli sensoriels et qu'elles dépendent des autres pour leurs soins [96]. Il existe une vaste documentation biomédicales sur l'EM/SFC [97,98], bien qu'elle ne soit pas bien connues des chercheur·euses et clinicien·nes d'autres domaines.
De nombreux·ses chercheur·euses ont commenté les similitudes entre l'EM/SFC et le COVID Long [99] ; on estime qu'environ la moitié des personnes atteintes de COVID Long répondent aux critères de l'EM/SFC [10,11,29,100], et dans les études où le symptôme principal de l'EM/SFC, le malaise post-effort, est mesuré, une majorité de personnes atteintes de COVID Long déclarent faire l'expérience du malaise post-effort [7,100]. Une étude sur le stress orthostatique chez des personnes souffrant de COVID Long et des personnes atteintes d'EM/SFC a révélé des anomalies hémodynamiques, symptomatiques et cognitives similaires dans les deux groupes par rapport aux personnes en bonne santé [101]. Il est important de noter qu'il n'est pas surprenant qu'une EM/SFC découle d'une infection par le SRAS-CoV-2, car 27,1 % des survivant·es d'une infection par le SRAS-CoV dans une étude répondaient aux critères de diagnostic de l'EM/SFC 4 ans après cette infection [102]. Un grand nombre d'agents pathogènes provoquent l'apparition de l'EM/SFC, notamment l'EBV, Coxiella burnetii (qui cause la fièvre Q), le virus de Ross River et le virus du Nil occidental [38].
Les anomalies constantes dans l'EM/SFC comprennent une diminution de la fonction des cellules tueuses naturelles, un épuisement des cellules T et d'autres anomalies des cellules T, un dysfonctionnement mitochondrial et des anomalies vasculaires et endothéliales, notamment des globules rouges déformés et un volume sanguin réduit. Parmi les autres anomalies, citons l'intolérance à l'effort, une consommation d'oxygène réduite et un seuil anaérobie réduit, ainsi que des profils métaboliques anormaux, notamment une utilisation altérée des acides gras et des acides aminés. Des altérations des fonctions neurologiques ont également été observées, notamment une neuroinflammation, une réduction du débit sanguin cérébral, des anomalies du tronc cérébral et un taux élevé de lactate ventriculaire, ainsi que des anomalies oculaires et visuelles. Une réactivation des herpèsvirus (notamment EBV, HHV-6, HHV-7 et cytomégalovirus humain) est également associée à l'EM/SFC [97,98,103,104].
Nombre de ces résultats ont été observés dans le cadre d'études sur le COVID Long, tant chez les adultes que chez les enfants (encadré 1). Les études sur le COVID Long ont mis en évidence un dysfonctionnement mitochondrial, notamment une perte du potentiel de la membrane mitochondriale [105] et un éventuel dysfonctionnement du métabolisme mitochondrial [106], une altération du métabolisme des acides gras et un dysfonctionnement du catabolisme lipidique dépendant des mitochondries, cohérents avec le dysfonctionnement mitochondrial dans l'intolérance à l'effort [107], le déséquilibre redox [108], et l'intolérance à I'effort et l'altération de l'extraction d'oxygène [100,109,110]. Des études ont également mis en évidence un dysfonctionnement endothélial [29], des anomalies du flux sanguin cérébral et des modifications métaboliques [81,111,112,113] (même chez les personnes présentant un COVID Long et dont les symptômes du POTS s'atténuent [114]), une neuroinflammation étendue [42,80], des herpèsvirus réactivés [18,21,27], des globules rouges déformés [64] et de nombreux résultats discutés ailleurs. On trouve des microcaillots et des plaquettes hyperactivées non seulement chez les personnes souffrant de COVID Long mais aussi chez les personnes atteintes d'EM/SFC [115].
La dysautonomie, en particulier le syndrome de tachycardie posturale (POTS), est souvent comorbide de l'EM/SFC [116] et a aussi souvent une origine virale [117]. Le POTS est associé aux auto-anticorps du récepteur adrénergique couplé à la protéine G et du récepteur muscarinique de l'acétylcholine, à une déficience du réservoir de stockage des plaquettes, à une neuropathie des petites fibres et à d'autres neuropathologies [118]. Le POTS et la neuropathie des petites fibres se retrouvent fréquemment dans les COVID Longs [111,119], une étude ayant trouvé un POTS chez 67% d'une cohorte de COVID Longs [120].
Le syndrome d'activation des mastocytes est également une comorbidité courante de l'EM/SFC. Le nombre et la gravité des symptômes du syndrome d'activation des mastocytes ont considérablement augmenté chez les patient·es atteint·es de COVID Long par rapport aux individus préCOVID et témoins [121], les antagonistes des récepteurs de l'histamine entraînant des améliorations chez la majorité des patient·es [19].
D'autres affections qui sont couramment comorbides avec l'EM/SFC comprennent les troubles du tissu conjonctif, notamment le syndrome d'Ehlers-Danlos et l'hypermobilité, les affections neuro-orthopédiques de la colonne vertébrale et du crâne, et l'endométriose [33,122,123]. Des données indiquent que ces affections peuvent également présenter une comorbidité avec le COVID Long. Le chevauchement des conditions post-virales avec ces conditions devrait être exploré davantage.
Système reproducteur
Des répercussions sur le système reproducteur sont souvent signalées dans les COVID Longs, bien que peu de recherches aient été menées pour documenter l'étendue de ces répercussions et la pathophysiologie spécifique au sexe. Les altérations menstruelles sont plus susceptibles de se produire chez les femmes et les personnes qui ont des menstruations avec un COVID Long que chez les femmes et les personnes qui ont des menstruations sans antécédents de COVID et celles qui ont eu un COVID-19 mais pas de COVID Long [124]. Les menstruations et la semaine précédant les menstruations ont été identifiées par les patient·es comme des déclencheurs de rechutes des symptômes du COVID Long [7]. Une baisse de la réserve ovarienne et un trouble endocrinien de la reproduction ont été observés chez les personnes atteintes de COVID-19 [125], et les premières théories suggèrent que l'infection par le SRAS-CoV-2 affecte la production d'hormones ovariennes et/ou la réponse endométriale en raison de l'abondance des récepteurs ACE2 sur les tissus ovariens et endométriaux [126]. Les personnes présentant à la fois des COVID-19 et des changements menstruelles étaient plus susceptibles de ressentir de la fatigue, des maux de tête, des douleurs corporelles et un essoufflement que celles qui ne présentaient pas de modifications menstruelles, et les modifications menstruelles les plus courantes étaient des menstruations irrégulières, une augmentation des symptômes prémenstruels et des menstruations peu fréquentes [127].
Les recherches sur l'EM/SFC montrent des associations entre l'EM/SFC et le trouble dysphorique prémenstruel, le syndrome des ovaires polykystiques, les anomalies du cycle menstruel, les kystes ovariens, la ménopause précoce et l'endométriose [128,129,130]. La grossesse, les changements post-partum, la périménopause et les fluctuations du cycle menstruel affectent l'EM/SFC et influencent les changements du métabolisme et du système immunitaire [129]. La recherche sur le COVID Long devrait se concentrer sur ces relations pour mieux comprendre la pathophysiologie.
La persistance virale dans le tissu pénien a été documentée, de même qu'un risque accru de dysfonctionnement érectile, résultant probablement d'un dysfonctionnement endothélial [131]. Dans une étude, des altérations de la numération des spermatozoïdes, du volume du sperme, de la motilité, de la morphologie des spermatozoïdes et de la concentration des spermatozoïdes ont été signalées chez les personnes atteintes de COVID Long par rapport aux personnes témoins, et ont été corrélées à des niveaux élevés de cytokines et à la présence de caspase 8, caspase 9 et caspase 3 dans le liquide séminal [132].
Système respiratoire
Les affections respiratoires sont un phénotype courant dans le COVID Long, et dans une étude, elles étaient deux fois plus fréquentes chez les survivant·es du COVID-19 que dans la population générale [2]. L'essoufflement et la toux sont les symptômes respiratoires les plus courants, et ont persisté pendant au moins 7 mois chez 40 % et 20 % des patient·es atteint·es de COVID Long, respectivement [7]. Plusieurs études d'imagerie incluant des personnes non hospitalisées atteintes de COVID Long ont démontré des anomalies pulmonaires, notamment au niveau du piégeage de l'air et de la perfusion pulmonaire [133,134]. Une étude immunologique et protéomique menée sur des patient·es 3 à 6 mois après l'infection a révélé une apoptose et des lésions épithéliales dans les voies respiratoires mais pas dans les échantillons de sang [135]. Une caractérisation immunologique plus poussée comparant des personnes ayant un COVID Long à des personnes qui s'étaient rétablies du COVID-19 a noté une corrélation entre la diminution de la fonction pulmonaire, l'inflammation systémique et les cellules T spécifiques du SRAS-CoV-2 [136].
Système gastro-intestinal
Les symptômes gastro-intestinaux du COVID Long comprennent les nausées, les douleurs abdominales, la perte d'appétit, les brûlures d'estomac et la constipation [137]. La composition du microbiote intestinal est significativement altérée chez les patient·es atteint·es de COVID-19 [23], et la dysbiose du microbiote intestinal est également une composante clé de l'EM/SFC [138]. Des niveaux plus élevés de Ruminococcus gnavus et de Bacteroides vulgatus et des niveaux plus faibles de Faecalibacterium prausnitzii ont été trouvés chez les personnes présentant un COVID Long par rapport aux témoins non atteint·es par le COVID-19 (avant la pandémie), avec une dysbiose intestinale qui dure au moins 14 mois ; de faibles niveaux de bactéries productrices de butyrate sont fortement corrélés à un COVID Long à 6 mois [24]. Les symptômes respiratoires et neurologiques persistants sont chacun associés à des agents pathogènes intestinaux spécifiques [24]. De plus, l'ARN du SRAS-CoV-2 est présent dans les échantillons de selles des patient·es atteint·es de COVID-19 [139], une étude indiquant une persistance dans les selles de 12,7 % des participant·es 4 mois après le diagnostic de COVID-19 et chez 3,8 % des participant·es 7 mois après le diagnostic [61]. La plupart des patient·es présentant des symptômes de COVID Long et une maladie intestinale inflammatoire 7 mois après l'infection présentaient une persistance d'antigène dans la muqueuse intestinale [140]. Des niveaux plus élevés de translocation fongique, provenant de l'intestin et/ou de l'épithélium pulmonaire, ont été trouvés dans le plasma des patient·es atteint·es de COVID Long par rapport aux patient·es sans COVID Long ou aux témoins séronégatifs pour le SRAS-CoV-2, induisant probablement la production de cytokines [141]. Le transfert de bactéries intestinales de patient·es atteint·es de COVID Long à des souris saines a entraîné une perte du fonctionnement cognitif et une altération des défenses pulmonaires chez les souris, qui ont été partiellement traitées avec la bactérie probiotique commensale Bifidobacterium longum [25].
Chronologies
L'apparition et l'évolution dans le temps des symptômes diffèrent selon les individus et le type de symptôme. Les symptômes neurologiques ont souvent une apparition retardée de plusieurs semaines à plusieurs mois : parmi les participant·es présentant des symptômes cognitifs, 43 % ont signalé une apparition retardée des symptômes cognitifs au moins un mois après le COVID-19, ce retard étant associé à un âge plus jeune [83]. Plusieurs symptômes neurocognitifs s'aggravent avec le temps et ont tendance à persister plus longtemps, alors que les symptômes gastro-intestinaux et respiratoires sont plus susceptibles de se résorber [7,74,142]. De plus, les douleurs aux articulations, aux os, aux oreilles, au cou et au dos sont plus fréquentes à 1 an qu'à 2 mois, tout comme la paresthésie, la perte de cheveux, la vision trouble et l'enflure des jambes, des mains et des pieds [143]. La parosmie se manifeste en moyenne 3 mois après l'infection initiale [144] ; contrairement aux autres symptômes neurocognitifs, elle diminue souvent avec le temps [143].
Peu de personnes souffrant de COVID Long se rétablissent complètement, une étude ayant constaté que 85 % des patient·es qui avaient des symptômes 2 mois après l'infection initiale présentaient des symptômes 1 an après l'apparition des symptômes [143]. Le pronostic futur est incertain, bien que les diagnostics d'EM/SFC et de dysautonomie soient généralement à vie.
Outils de diagnostic et traitements
Bien que des outils diagnostiques existent pour certaines composantes du COVID Long (par exemple, les tests d'inclinaison pour le POTS [145] et les examens IRM pour détecter les atteintes cardiovasculaires [68]), les outils diagnostiques pour le COVID Long sont pour la plupart en cours de développement, notamment l'imagerie pour détecter les microcaillots [63], la microscopie cornéenne pour identifier la neuropathie à petites fibres [87], la nouvelle fragmentation du complexe QRS sur les électrocardiogrammes comme indicateur de lésion cardiaque [146] et l'utilisation de l'IRM hyperpolarisée pour détecter les anomalies des échanges gazeux pulmonaires [147]. Sur la base des tests qui sont proposés dans le cadre des soins standard, les résultats des patient·es atteint·es de COVID Long sont souvent normaux ; de nombreux·ses prestataires de soin ne sont pas au courant des tests spécifiques aux symptômes et des recommandations diagnostiques de la communauté de l'EM/SFC [148]. Les premières recherches sur les biomarqueurs suggèrent que les niveaux de vésicules extracellulaires [85] et/ou les marqueurs immunitaires indiquant une cytotoxicité élevée [149] pourraient être indicatifs d'un COVID Long. Il est intriguant de constater que les chiens peuvent identifier les personnes atteintes de COVID Long sur la base d'échantillons de sueur [150]. La recherche de biomarqueurs dans l'EM/SFC peut également s'appliquer au COVID Long, y compris les tests sanguins d'impédance électrique, les tests salivaires, la déformation des érythrocytes, les profils lipidiques plasmatiques spécifiques au sexe et les variables liées au tamponnement isocapnique [151,152,153,154]. On ne saurait trop insister sur l'importance de développer et de valider des biomarqueurs pouvant être utilisés pour le diagnostic du COVID Long - ils seront non seulement utiles pour établir le diagnostic mais aussi pour définir objectivement les réponses au traitement.
S'il n'existe actuellement aucun traitement efficace à grande échelle pour le COVID Long, les traitements de certaines composantes se sont avérés efficaces pour des sous-ensembles de populations (tableau 1). De nombreuses stratégies pour l'EM/SFC sont efficaces pour les personnes atteintes de COVID Long, y compris le pacing [7,37] et les options pharmacologiques spécifiques aux symptômes (par exemple, les β-bloquants pour le POTS, la naltrexone à faible dose pour la neuroinflammation [155] et l'immunoglobuline intraveineuse pour le dysfonctionnement immunitaire) et les options non pharmacologiques (y compris l'augmentation de la consommation de sel pour le POTS, le pacing cognitif pour le dysfonctionnement cognitif et les régimes d'élimination pour les symptômes gastro-intestinaux) [96]. La naltrexone à faible dose a été utilisée dans de nombreuses maladies, y compris l'EM/SFC [155], et s'est également révélée prometteuse dans le traitement du COVID Long [156]. Les antihistaminiques H1 et H2, qui suivent souvent les protocoles relatifs au syndrome d'activation des mastocytes et font notamment appel à la famotidine, sont utilisés pour soulager un large éventail de symptômes [19,157], bien qu'ils ne constituent pas un remède. Un autre médicament, le BC007, s'attaque potentiellement à l'auto-immunité en neutralisant les niveaux d'auto-anticorps des récepteurs couplés aux protéines G158. Les régimes anticoagulants sont un moyen prometteur de traiter les anomalies de la coagulation [159] ; dans une étude, la résolution des symptômes a été observée chez les 24 patient·es recevant une triple thérapie anticoagulante [31]. L'aphérèse s'est également avérée prometteuse pour soulager les symptômes du COVID Long ; on a émis l'hypothèse qu'elle pouvait aider à éliminer les microcaillots [160] et il a été démontré qu'elle réduisait les auto-anticorps dans l'EM/SFC [161]. Cependant, il est assez coûteux, et ses avantages demeurent incertains. Certains suppléments se sont révélés prometteurs dans le traitement du COVID Long et de l'EM/SFC, notamment la coenzyme Q10 et le d-ribose [162], et pourraient mériter une étude plus approfondie.
Tableau 1 : Résumé des traitements candidats et données à l'appui
https://www.nature.com/articles/s41579-022-00846-2/tables/1
Il est à noter que l'exercice est néfaste pour les patient·es atteint·es de COVID Long qui souffrent d'EM/SFC ou de malaise post-effort [110,163] et qu'il ne devrait pas être utilisé comme traitement [164,165,166] ; une étude sur des personnes atteintes de COVID Long a noté que l'activité physique aggravait l'état de 75 % des patient·es, et que moins de 1 % d'entre elleux voyaient leur état s'améliorer [109].
Des études pilotes et des rapports de cas ont montré que d'autres options de traitement méritent d'être explorées. Un rapport de cas a noté une résolution du COVID Long suite à un traitement avec l'antiviral Paxlovid [167], et une étude portant sur le traitement du COVID-19 aigu avec Paxlovid a montré une réduction de 25% de l'incidence du COVID Long [168] ; Paxlovid devrait être étudié davantage pour la prévention et le traitement du COVID Long. Un petit essai de sulodexide chez des personnes souffrant de dysfonctionnement endothélial a permis de réduire la gravité des symptômes [169]. Des études pilotes sur les probiotiques ont indiqué un potentiel de soulagement des symptômes gastro-intestinaux et non gastro-intestinaux [170,171]. Deux patient·es avec un COVID Long ont connu un soulagement substantiel des symptômes de la dysautonomie après un blocage du ganglion stellaire [172]. Une première étude a noté que le Pycnogénol améliorait de manière statistiquement significative les mesures physiologiques (par exemple, la réduction du stress oxydatif) et la qualité de vie (indiquée par des scores plus élevés à l'échelle de performance de Karnofsky) [173,174], comme cela a été supposé sur la base du succès d'autres études cliniques.
Dans l'ensemble, les options thérapeutiques actuelles sont basées sur des études pilotes à petite échelle sur le COVID Long ou sur ce qui s'est avéré efficace dans d'autres maladies ; plusieurs autres essais sont en cours [175]. Il existe un large éventail d'options de traitement possibles de l'EM/SFC couvrant divers mécanismes, notamment l'amélioration des fonctions des cellules tueuses naturelles, l'élimination des auto-anticorps, les immunosuppresseurs, les antiviraux pour les herpèsvirus réactivés, les antioxydants, le soutien mitochondrial et la génération d'énergie mitochondriale [176,177] ; la plupart doivent faire l'objet d'essais cliniques, ce qui devrait être fait de toute urgence. De nombreuses options thérapeutiques plus récentes restent sous-explorées, notamment les anticoagulants et les antiviraux spécifiques du SRAS-CoV-2, et le manque de financement constitue une limite importante à la réalisation d'essais solides.
Impact des vaccins, des variants et des réinfections
L'impact de la vaccination sur l'incidence des COVID Longs diffère selon les études, en partie à cause des différences de méthodes d'étude, du temps écoulé depuis la vaccination et des définitions du COVID Long. Une étude n'indique aucune différence significative dans le développement du COVID Long entre les personnes vaccinées et les personnes non vaccinées [178] ; d'autres études indiquent que les vaccins offrent une protection partielle, avec une réduction du risque de COVID Long entre 15 % et 41% [4,5], le COVID Long continuant à toucher 9 % des personnes atteintes par le COVID-19.
Les différents variants du SRAS-CoV-2 et le niveau de vaccination (et le temps écoulé depuis) peuvent avoir une incidence sur le développement de COVID Long. L'Office for National Statistics du Royaume-Uni a constaté que le COVID Long était 50 % moins fréquent avec Omicron BA.1 chez les participant·es doublement vacciné·es qu’avec Delta, mais qu'il n'y avait pas de différence significative entre les participant·es triplement vacciné·es ; il a également constaté que le COVID Long était plus fréquent après une infection par Omicron BA.2 qu'après une infection par le BA.1 chez les participant·es triplement vacciné·es, 9,3 % d'entre elleux développant un COVID Long à la suite d'une infection par le variant BA.2 [179].
L'impact de la vaccination sur les symptômes du COVID Long chez les personnes qui avaient déjà développé un COVID Long diffère selon les patient·es, 16,7 % d'entre elleux ayant vu leurs symptômes s'atténuer, 21,4 % ayant vu leurs symptômes s'aggraver et le reste ayant vu ses symptômes inchangés [180].
Les réinfections sont de plus en plus fréquentes [181]. Il est crucial de comprendre l'impact de la multiplication des cas de COVID-19, y compris le taux de COVID Long chez celleux qui se sont rétablis·e d'une première infection mais ont développé un COVID Long à la suite d'une réinfection, et l'impact de la réinfection sur celleux qui ont un COVID Long préexistant afin d'éclairer les décisions politiques futures. Les premières recherches montrent un risque croissant de séquelles de COVID Long après la deuxième et la troisième infection, même chez les personnes doublement et triplement vaccinées [182]. La littérature existante indique que les infections multiples peuvent causer des dommages supplémentaires ou une sensibilité à des manifestations de type EM/SFC [33,183].
Des preuves préliminaires indiquent également que certaines réponses immunitaires chez les personnes atteintes d'un COVID Long, notamment de faibles niveaux d'anticorps protecteurs et des niveaux élevés d'auto-anticorps, peuvent laisser supposer une susceptibilité accrue à la réinfection [27].
Enjeux et recommandations
Les problèmes relatifs aux tests PCR et aux tests d'anticorps tout au long de la pandémie, les récits inexacts sur la pandémie et le manque généralisé de connaissances post-virales ont entraîné des problèmes en aval et des biais dans la recherche et les soins liés au COVID Long.
Problèmes liés aux tests
La plupart des patient·es atteint·es de COVID-19 lors des premières vagues n'avaient pas d'infection confirmée en laboratoire, les tests PCR étant difficiles d'accès à moins que les personnes ne soient hospitalisées. Seuls 1 à 3 % des cas jusqu'en mars 2020 ont probablement été détectés [184], et les CDC estiment que seulement 25 % des cas aux États-Unis ont été signalés de février 2020 à septembre 2021 [185] ; ce pourcentage a probablement diminué avec l'augmentation de l'utilisation des tests rapides à domicile.
Bien que les tests PCR soient notre meilleur outil pour détecter les infections par le SRAS-CoV-2, leurs taux de faux négatifs sont encore élevés [186]. Un biais supplémentaire est causé par les taux de faux négatifs qui sont plus élevés chez les femmes et les adultes de moins de 40 ans [187], chez celleux qui ont une faible charge virale [188] et chez les enfants (encadré 1), plusieurs études montrant que 52 à 90 % des cas chez les enfants sont manqués par les tests PCR [189,190]. Le taux élevé de PCR faussement négatifs fait que les patients symptomatiques du COVID-19, qui cherchent un test de COVID-19 mais reçoivent un résultat faussement négatif, sont inclus comme contrôle dans de nombreuses études. Celleux qui ont un résultat positif au test PCR (qui ont plus de chances d'être inclus·es dans la recherche) sont plus souvent des hommes ou ont une charge virale plus élevée. En outre, le manque d'accessibilité au test ainsi que les taux de faux négatifs ont créé un obstacle important aux soins, car de nombreuses cliniques COVID Long exigent des tests PCR pour l'admission.
De même, il existe une idée fausse très répandue selon laquelle tout le monde fabrique et conserve des anticorps anti-SRAS-CoV-2, et de nombreux·ses clinicien·nes et chercheur·euses ne sont pas conscient·es de l'utilité limitée des tests d'anticorps pour déterminer une infection antérieure. Entre 22 % et 36 % des personnes infectées par le SRAS-CoV-2 ne séroconvertissent pas, et beaucoup d'autres perdent leurs anticorps au cours des premiers mois, la non-séroconversion et la séroreversion étant plus probables chez les femmes, les enfants et les personnes présentant des infections bénignes [52,53,191,192,193]. Quatre et huit mois après l'infection, chez 19 % et 61% des patient·es, respectivement, qui avaient eu des infections légères et avaient développé des anticorps on constatait une séroreversion, contre 2 % et 29 % des patient·es, respectivement, qui avaient des infections graves [191]. Pourtant, de nombreux·se clinicien·nes et chercheur·euses utilisent les tests d'anticorps pour inclure ou exclure les patient·es atteint·es par le COVID-19 des groupes témoins.
En outre, pendant les périodes d'inaccessibilité des tests, les tests ont été effectués sur une base de patient·es présentant des symptômes spécifiques au COVID-19 tels que la perte de l'odorat et du goût, la fièvre et les symptômes respiratoires, ce qui a entraîné un biais en faveur des personnes présentant ces symptômes.
Des informations erronées sur les tests PCR et les tests d'anticorps ont conduit à classer des patient·es atteint·es de COVID Long dans des groupes témoins non COVID-19, ce qui a biaisé les résultats des recherches. Étant donné que des niveaux d'anticorps et une charge virale faibles ou inexistant·es peuvent être liés à la physiopathologie du COVID Long, l'inclusion de cohortes diagnostiquées cliniquement renforcera la recherche.
Erreurs importantes
Le récit selon lequel le COVID-19 ne présentait que des séquelles respiratoires a conduit à une prise de conscience tardive des impacts neurologiques, cardiovasculaires et autres impacts multisystémiques du COVID-19. De nombreuses cliniques et prestataires de soin pour le COVID Long se concentrent encore de manière disproportionnée sur la réhabilitation respiratoire, ce qui se traduit par des données biaisées dans les dossiers médicaux électroniques. Les données des dossiers de santé électroniques sont également plus complètes pour les personnes hospitalisées pour le COVID-19 que pour celles qui ont reçu des soins communautaires, ce qui entraîne un biais en faveur de la présentation respiratoire sévère plus traditionnelle et moins d'attention pour les patient·es non hospitalisé·es, qui ont tendance à avoir des présentations neurologiques et/ou de type EM/SFC.
L'idée que les cas initialement bénins de COVID-19, généralement définis comme ne nécessitant pas d'hospitalisation en phase aiguë, n'auraient pas de conséquences à long terme a également eu des effets sur la recherche. Ces cas dits bénins qui se traduisent par un COVID Long ont souvent une biologie sous-jacente différente de celle des cas graves en phase aiguë, mais les mêmes types de tests sont utilisés pour évaluer les patient·es. Et ce malgré le fait que les tests de base tels que les D-dimères, la protéine C-réactive (CRP), les anticorps antinucléaires et la formule sanguine complète sont connus pour donner des résultats souvent normaux chez les patient·es atteint·es de COVID Long. Les tests qui donnent des résultats anormaux chez les patient·es atteint·es d'EM/SFC et de dysautonomie, tels que les tests d'immunoglobulines totales, les tests de fonction des cellules tueuses naturelles, le test tilt-table ou le test d'inclinaison de la NASA, le test du cortisol salivaire en quatre points, les panels d'herpèsvirus réactivés, la biopsie de la neuropathie des petites fibres et les tests recherchant une perfusion cérébrale anormale [96], devraient plutôt être priorisés. Parmi les autres problèmes récurrents, citons le fait que les études n'incluent pas toute la gamme des symptômes, en particulier les symptômes neurologiques et ceux liés au système reproducteur, et qu'elles n'interrogent pas les patient·es sur la fréquence, la gravité et l'incapacité induite par les symptômes. Les symptômes centraux tels que le malaise post-effort ne sont pas largement connus et sont donc rarement inclus dans les plans d'étude.
Manque généralisé de connaissances post-virales et désinformation
Le manque généralisé de connaissances sur les maladies d'origine virale, en particulier l'EM/SFC et la dysautonomie, ainsi qu'un codage souvent imparfait, empêchent ces affections d'être identifiées et documentées par les clinicien·nes ; cela signifie qu'elles sont fréquemment absentes des données des dossiers médicaux électroniques. De plus, comme la recherche sur l'EM/SFC et la dysautonomie n'est pas largement connue ni enseignée de façon exhaustive dans les facultés de médecine [194], la recherche sur le COVID Long ne s'appuie souvent pas sur les résultats antérieurs et a tendance à répéter d'anciennes hypothèses. De plus, les études sur le COVID Long et les antécédents médicaux ont tendance à ne documenter que les facteurs de risque du COVID-19 aigu grave, qui sont différents des facteurs de risque des affections qui recoupent le COVID Long comme l'EM/SFC et la dysautonomie (par exemple, les troubles du tissu conjonctif comme le syndrome d'Ehlers-Danlos, les maladies antérieures comme la mononucléose infectieuse et l'atteinte des mastocytes) [33,195,196].
Les clinicien·nes qui ne sont pas familier·es avec l'EM/SFC et la dysautonomie diagnostiquent souvent à tort des troubles de santé mentale chez les patient·es ; quatre patient·es sur cinq atteints de POTS reçoivent un diagnostic de trouble psychiatrique ou psychologique avant de recevoir un diagnostic de POTS, et seulement 37 % d'entre elleux continuent de recevoir un diagnostic psychiatrique ou psychologique une fois reçu le diagnostic de POTS [117]. Les chercheur·euses qui ne sont pas familier·es avec l'EM/SFC et la dysautonomie ne savent souvent pas qu'il faut utiliser des outils validés spécifiques lorsqu'iels effectuent des tests de santé mentale, car les échelles d'anxiété incluent souvent des symptômes autonomes comme la tachycardie, et les échelles de dépression incluent souvent des symptômes comme la fatigue, ce qui dans les deux cas surestime la prévalence des troubles de santé mentale dans ces affections [197,198].
Recommandations
Si la recherche sur les COVID Longs s'est étendue et accélérée, les recherches existantes ne suffisent pas à améliorer les résultats pour les personnes atteintes de COVID Longs. Pour assurer une réponse adéquate à la crise du COVID Long, nous avons besoin d'une recherche qui s'appuie sur les connaissances existantes et qui tienne compte de l'expérience des patient·es, de la formation et de l'éducation du personnel de santé et de recherche, d'une campagne de communication publique, de politiques et de financements solides pour soutenir la recherche et les soins dans le domaine du COVID Long.
Recherche
Nous avons besoin d'un programme de recherche complet sur le COVID Long qui s'appuie sur les connaissances existantes sur l'EM/SFC, la dysautonomie et d'autres affections d'origine virale, y compris, mais sans s'y limiter, l'inflammation du cerveau et du tronc cérébral, les techniques de neuro-imagerie appropriées, la neuro-immunologie, le profilage métabolique, l'altération de la fonction endothéliale, la fragmentation mitochondriale, les phénotypes antiviraux et métaboliques, l'hypoperfusion/le débit sanguin cérébral, tests de diagnostic par nano-aiguilles, chevauchements avec les troubles du tissu conjonctif, auto-immunité et auto-anticorps, persistance virale/microbienne, hypertension intracrânienne, hypermobilité, obstructions cranio-cervicales, altération des cellules T et B, métabolomique et protéomique, élévation du taux de lactate sanguin, réactivations d'herpèsvirus, modifications immunitaires au cours des premières et des dernières années post-virales, et modifications du microbiote intestinal. Les mécanismes et les chevauchements entre le COVID Long et l'atteinte du tissu conjonctif, les mastocytes et les affections inflammatoires telles que l'endométriose sont particulièrement peu étudiés et devraient faire l'objet d'une attention particulière. En raison de la prévalence élevée de l'EM/SFC, du POTS et d'autres maladies post-infectieuses chez les patient·es atteint·es de COVID Long, la recherche sur le COVID Long devrait inclure des personnes qui ont développé l'EM/SFC et d'autres maladies post-infectieuses à partir d'un déclencheur autre que le SRAS-CoV-2 dans des groupes de comparaison afin d'améliorer la compréhension de l'apparition et de la pathophysiologie de ces maladies113. De plus, on sait qu'un processus d'épuisement immunitaire se produit entre la deuxième et la troisième année de la maladie dans le cas de l'EM/SFC, les résultats des tests de cytokines étant différents chez les patient·es qui ont été malades pendant de courtes périodes (moins de 2 ans) et chez celleux qui ont été malades pendant de plus longues périodes [43]. Pour cette raison, les études devraient mettre en œuvre des sous-analyses basées sur la durée de la maladie des participant·es. Étant donné que la recherche sur l'EM/SFC et la dysautonomie n'est pas très connue dans le domaine biomédical, la recherche sur le COVID Long devrait être menée par des expert·es de ces domaines afin de s'appuyer sur les recherches existantes et créer de nouveaux outils de diagnostic et d'imagerie.
Des essais cliniques rigoureux doivent être une priorité pour l'avenir, car les patient·es ont actuellement peu d'options de traitement. En l'absence d'options thérapeutiques validées, les patient·es et les médecins mènent des expériences individuelles, ce qui entraîne une duplication des efforts sans connaissances généralisables et pose des risques indus pour les patient·es. Les institutions de financement et les clinicien·nes-chercheur·euses doivent accorder la priorité à la conception d'études rigoureuses et au partage des connaissances.
Il est essentiel que la recherche sur le COVID Long soit représentative (ou sur-échantillonnée) des populations qui ont eu le COVID-19 et qui développent le COVID Long à des taux élevés, c'est-à-dire de façon disproportionnée les personnes de couleur [35]. La recherche médicale a historiquement sous-représenté ces populations, et la surreprésentation des patient·es blanc·hes et socio-économiquement privilégié·es a été courante dans la recherche sur le COVID Long. Les chercheur·euses doivent travailler au sein des communautés de couleur, des communautés LGBTQ+ et des communautés à faible revenu afin d'instaurer la confiance et mener des études culturellement compétentes qui permettront de comprendre et de traiter le COVID Long des populations marginalisées.
Comme un sous-ensemble de patient·es verra ses symptômes s'améliorer avec le temps, et que d'autres auront des symptômes épisodiques, il faut veiller à intégrer la possibilité d'une atténuation des symptômes dans la conception de l'étude, et veiller à ne pas attribuer l'amélioration à une cause particulière sans modélisation appropriée.
Enfin, il est essentiel que les communautés de patient·es atteint·es de COVID Long et d'affections associées participent de manière significative à la recherche et aux essais cliniques sur les COVID Long. Les connaissances de celleux qui vivent une maladie sont cruciales pour identifier une conception d'étude appropriée et des questions et solutions de recherche clés, améliorant ainsi la vitesse et la direction de la recherche.
Formation et éducation du personnel de santé et de recherche
Pour préparer la prochaine génération de professionnel·les de la santé et de chercheur·euses, les écoles de médecine doivent améliorer leur enseignement sur les pandémies, les virus et les maladies d'origine infectieuse comme le COVID Long et l'EM/SFC, et les évaluations des compétences devraient inclure ces maladies. En 2013, seulement 6 % des écoles de médecine couvraient entièrement l'EM/SFC dans les domaines du traitement, de la recherche et des programmes d'études, ce qui a créé des obstacles aux soins, au diagnostic précis, à la recherche et au traitement [194]. Pour s'assurer que les personnes atteintes de COVID Long et de maladies associées puissent recevoir des soins adéquats dès maintenant, les sociétés professionnelles et les organismes gouvernementaux doivent éduquer le personnel de santé et de recherche sur ces maladies, y compris sur l'historique et les meilleures pratiques actuelles concernant l'EM/SFC, afin de ne pas répéter les erreurs du passé, qui ont aggravé le pronostic des malades. La communauté des chercheur·euses a fait un faux pas dans ses efforts pour traiter l'EM/SFC [199], et certain·es médecins, mal informé·es de l'étiologie et de la physiopathologie du trouble, conseillent encore aux malades de poursuivre des interventions néfastes comme la thérapie par exercices gradués et la thérapie cognitivo-comportementale, malgré les dommages que ces interventions causent [200] et le fait qu'elles sont explicitement déconseillées comme traitements [163,164,166].
Campagne de communication publique
En plus de fournir des informations sur le COVID Long à la communauté biomédicale, nous avons besoin d'une campagne de communication publique qui informe le public sur les risques et les conséquences du COVID Long.
Politiques et financement
Enfin, nous avons besoin de politiques et de financements qui soutiendront la recherche sur les COVID Longs et permettront aux personnes atteintes de COVID Longs de recevoir des soins et un soutien adéquats. Par exemple, aux États-Unis, la création d'un institut national pour les maladies chroniques complexes au sein des NIH contribuerait grandement à fournir un mécanisme de financement durable et un programme de recherche solide. En outre, nous devons créer et financer des centres d'excellence, qui fourniraient des soins inclusifs, historiquement informés et culturellement compétents, ainsi que des recherches et une formation médicale aux prestataires de soins primaires. En outre, la recherche et les soins cliniques n'existent pas en vase clos. Il est essentiel de faire avancer les politiques qui traitent à la fois des déterminants sociaux de la santé et du soutien social dont ont besoin les personnes handicapées.
Conclusions
Le COVID Long est une maladie multisystémique qui inclut l'EM/SFC, la dysautonomie, des répercussions sur de multiples systèmes organiques et des anomalies vasculaires et de coagulation. Elle a déjà affaibli des millions d'individus dans le monde, et ce nombre ne cesse d'augmenter. Sur la base de plus de deux ans de recherche sur le COVID Long et de décennies de recherche sur des maladies telles que l'EM/SFC, une proportion importante de personnes atteintes de COVID Long pourraient être handicapées à vie si aucune mesure n'est prise. Les options de diagnostic et de traitement sont actuellement insuffisantes, et de nombreux essais cliniques sont nécessaires de toute urgence pour tester rigoureusement les traitements qui s'attaquent aux mécanismes biologiques sous-jacents hypothétiques, notamment la persistance virale, la neuroinflammation, la coagulation sanguine excessive et l'auto-immunité.
Publication originale (13/01/2023) :
Nature Reviews Microbiology
· Cet article fait partie de notre dossier COVID Long du 21 février 2023 ·
Références
Ballering, A. V., van Zon, S. K. R., Hartman, T. C. O. & Rosmalen, J. G. M. Persistence of somatic symptoms after COVID-19 in the Netherlands: an observational cohort study. Lancet 400, 452–461 (2022).
Bull-Otterson, L. Post–COVID conditions among adult COVID-19 survivors aged 18–64 and ≥65 years — United States, March 2020–November 2021. MMWR Morb. Mortal. Wkly Rep. 71, 713 (2022).
Ceban, F. et al. Fatigue and cognitive impairment in post-COVID-19 syndrome: a systematic review and meta-analysis. Brain Behav. Immun. 101, 93–135 (2022).
Al-Aly, Z., Bowe, B. & Xie, Y. Long COVID after breakthrough SARS-CoV-2 infection. Nat. Med. https://doi.org/10.1038/s41591-022-01840-0 (2022).
Ayoubkhani, D. et al. Risk of Long Covid in people infected with SARS-CoV-2 after two doses of a COVID-19 vaccine: community-based, matched cohort study. Preprint at medRxiv https://doi.org/10.1101/2022.02.23.22271388 (2022).
FAIR Health. Patients Diagnosed with Post-COVID Conditions: An Analysis of Private Healthcare Claims Using the Official ICD-10 Diagnostic Code (FAIR Health, 2022).
Davis, H. E. et al. Characterizing long COVID in an international cohort: 7 months of symptoms and their impact. eClinicalMedicine 38, 101019 (2021).
Xie, Y., Xu, E., Bowe, B. & Al-Aly, Z. Long-term cardiovascular outcomes of COVID-19. Nat. Med. 28, 583–590 (2022).
Xie, Y. & Al-Aly, Z. Risks and burdens of incident diabetes in long COVID: a cohort study. Lancet Diabetes Endocrinol. 10, 311–321 (2022).
Mancini, D. M. et al. Use of cardiopulmonary stress testing for patients with unexplained dyspnea post–coronavirus disease. JACC Heart Fail. 9, 927–937 (2021).
Kedor, C. et al. A prospective observational study of post-COVID-19 chronic fatigue syndrome following the first pandemic wave in Germany and biomarkers associated with symptom severity. Nat. Commun. 13, 5104 (2022).
Larsen, N. W. et al. Characterization of autonomic symptom burden in long COVID: a global survey of 2314 adults. Front. Neurol. 13, 1012668 (2022).
Demko, Z. O. et al. Post-acute sequelae of SARS-CoV-2 (PASC) impact quality of life at 6, 12 and 18 months post-infection. Preprint at medRxiv https://doi.org/10.1101/2022.08.08.22278543 (2022).
Cairns, R. & Hotopf, M. A systematic review describing the prognosis of chronic fatigue syndrome. Occup. Med. Oxf. Engl. 55, 20–31 (2005).
Bach, K. Is ‘long Covid’ worsening the labor shortage? Brookings https://www.brookings.edu/research/is-long-covid-worsening-the-labor-shortage/ (2022).
Swank, Z. et al. Persistent circulating severe acute respiratory syndrome coronavirus 2 spike is associated with post-acute coronavirus disease 2019 sequelae. Clin. Infect. Dis. https://doi.org/10.1093/cid/ciac722 (2022).
Proal, A. D. & VanElzakker, M. B. Long COVID or post-acute sequelae of COVID-19 (PASC): an overview of biological factors that may contribute to persistent symptoms. Front. Microbiol. 12, 698169 (2021).
Klein, J. et al. Distinguishing features of Long COVID identified through immune profiling. Preprint at medRxiv https://doi.org/10.1101/2022.08.09.22278592 (2022).
Glynne, P., Tahmasebi, N., Gant, V. & Gupta, R. Long COVID following mild SARS-CoV-2 infection: characteristic T cell alterations and response to antihistamines. J. Investig. Med. 70, 61–67 (2022).
Phetsouphanh, C. et al. Immunological dysfunction persists for 8 months following initial mild-to-moderate SARS-CoV-2 infection. Nat. Immunol. 23, 210–216 (2022).
Zubchenko, S., Kril, I., Nadizhko, O., Matsyura, O. & Chopyak, V. Herpesvirus infections and post-COVID-19 manifestations: a pilot observational study. Rheumatol. Int. https://doi.org/10.1007/s00296-022-05146-9 (2022).
Peluso, M. J. et al. Evidence of recent Epstein-Barr virus reactivation in individuals experiencing Long COVID. Preprint at medRxiv https://doi.org/10.1101/2022.06.21.22276660 (2022).
Yeoh, Y. K. et al. Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut 70, 698–706 (2021).
Liu, Q. et al. Gut microbiota dynamics in a prospective cohort of patients with post-acute COVID-19 syndrome. Gut 71, 544–552 (2022).
Mendes de Almeida, V. Gut microbiota from patients with mild COVID-19 cause alterations in mice that resemble post-COVID syndrome. Res. Sq. https://doi.org/10.21203/rs.3.rs-1756189/v1 (2022).
Wallukat, G. et al. Functional autoantibodies against G-protein coupled receptors in patients with persistent long-COVID-19 symptoms. J. Transl Autoimmun. 4, 100100 (2021).
Su, Y. et al. Multiple early factors anticipate post-acute COVID-19 sequelae. Cell 185, 881–895.e20 (2022).
Arthur, J. M. et al. Development of ACE2 autoantibodies after SARS-CoV-2 infection. PLoS ONE 16, e0257016 (2021).
Haffke, M. et al. Endothelial dysfunction and altered endothelial biomarkers in patients with post-COVID-19 syndrome and chronic fatigue syndrome (ME/CFS). J. Transl Med. 20, 138 (2022).
Charfeddine, S. Long COVID 19 syndrome: is it related to microcirculation and endothelial dysfunction? Insights from TUN-EndCOV study. Front. Cardiovasc. Med. https://doi.org/10.3389/fcvm.2021.745758 (2021).
Pretorius, E. et al. Prevalence of symptoms, comorbidities, fibrin amyloid microclots and platelet pathology in individuals with Long COVID/post-acute sequelae of COVID-19 (PASC). Cardiovasc. Diabetol. 21, 148 (2022).
Spudich, S. & Nath, A. Nervous system consequences of COVID-19. Science 375, 267–269 (2022).
Renz-Polster, H., Tremblay, M.-E., Bienzle, D. & Fischer, J. E. The pathobiology of myalgic encephalomyelitis/chronic fatigue syndrome: the case for neuroglial failure. Front. Cell. Neurosci. 16, 888232 (2022).
Merzon, E. et al. Clinical and socio-demographic variables associated with the diagnosis of long COVID syndrome in youth: a population-based study. Int. J. Environ. Res. Public Health 19, 5993 (2022).
CDC. Long COVID - household pulse survey - COVID-19. CDC https://www.cdc.gov/nchs/covid19/pulse/long-covid.htm (2022).
Williamson, A. E., Tydeman, F., Miners, A., Pyper, K. & Martineau, A. R. Short-term and long-term impacts of COVID-19 on economic vulnerability: a population-based longitudinal study (COVIDENCE UK). BMJ Open 12, e065083 (2022).
Ziauddeen, N. et al. Characteristics and impact of Long Covid: findings from an online survey. PLoS ONE 17, e0264331 (2022).
Choutka, J., Jansari, V., Hornig, M. & Iwasaki, A. Unexplained post-acute infection syndromes. Nat. Med. 28, 911–923 (2022).
Komaroff, A. L. & Lipkin, W. I. Insights from myalgic encephalomyelitis/chronic fatigue syndrome may help unravel the pathogenesis of postacute COVID-19 syndrome. Trends Mol. Med. 27, 895–906 (2021).
Schultheiß, C. et al. From online data collection to identification of disease mechanisms: the IL-1ß, IL-6 and TNF-α cytokine triad is associated with post-acute sequelae of COVID-19 in a digital research cohort. SSRN https://doi.org/10.2139/ssrn.3963839 (2021).
Peluso, M. J. et al. Markers of immune activation and inflammation in individuals with postacute sequelae of severe acute respiratory syndrome coronavirus 2 infection. J. Infect. Dis. 224, 1839–1848 (2021).
Fernández-Castañeda, A. et al. Mild respiratory SARS-CoV-2 infection can cause multi-lineage cellular dysregulation and myelin loss in the brain. Preprint at bioRxiv https://doi.org/10.1101/2022.01.07.475453 (2022).
Hornig, M. et al. Distinct plasma immune signatures in ME/CFS are present early in the course of illness. Sci. Adv. 1, e1400121 (2015).
Wang, E. Y. et al. Diverse functional autoantibodies in patients with COVID-19. Nature 595, 283–288 (2021).
Shikova, E. et al. Cytomegalovirus, Epstein-Barr virus, and human herpesvirus-6 infections in patients with myalgic еncephalomyelitis/chronic fatigue syndrome. J. Med. Virol. 92, 3682–3688 (2020).
Schreiner, P. et al. Human herpesvirus-6 reactivation, mitochondrial fragmentation, and the coordination of antiviral and metabolic phenotypes in myalgic encephalomyelitis/chronic fatigue syndrome. Immunohorizons 4, 201–215 (2020).
García-Abellán, J. et al. Antibody response to SARS-CoV-2 is associated with long-term clinical outcome in patients with COVID-19: a longitudinal study. J. Clin. Immunol. 41, 1490–1501 (2021).
Augustin, M. et al. Post-COVID syndrome in non-hospitalised patients with COVID-19: a longitudinal prospective cohort study. Lancet Reg. Health Eur. 6, 100122 (2021).
Talla, A. et al. Longitudinal immune dynamics of mild COVID-19 define signatures of recovery and persistence. Preprint at bioRxiv https://doi.org/10.1101/2021.05.26.442666 (2021).
Peluso, M. J. et al. Long-term SARS-CoV-2-specific immune and inflammatory responses in individuals recovering from COVID-19 with and without post-acute symptoms. Cell Rep. 36, 109518 (2021).
Hu, F. et al. A compromised specific humoral immune response against the SARS-CoV-2 receptor-binding domain is related to viral persistence and periodic shedding in the gastrointestinal tract. Cell. Mol. Immunol. 17, 1119–1125 (2020).
Korte, W. et al. SARS-CoV-2 IgG and IgA antibody response is gender dependent; and IgG antibodies rapidly decline early on. J. Infect. 82, e11–e14 (2021).
Jo, W. et al. A two-phase, single cohort study of COVID-19 antibody sera-surveillance. Ann. Epidemiol. Public Health 4, 1055 (2021).
Nomura, Y. et al. Attenuation of antibody titers from 3 to 6 months after the second dose of the BNT162b2 vaccine depends on sex, with age and smoking risk factors for lower antibody titers at 6 months. Vaccines 9, 1500 (2021).
Tejerina, F. et al. Post-COVID-19 syndrome. SARS-CoV-2 RNA detection in plasma, stool, and urine in patients with persistent symptoms after COVID-19. BMC Infect. Dis. 22, 211 (2022).
Goh, D. et al. Persistence of residual SARS-CoV-2 viral antigen and RNA in tissues of patients with long COVID-19. Preprint at https://www.researchsquare.com/article/rs-1379777/v1 (2022).
Ceulemans, L. J. et al. Persistence of SARS-CoV-2 RNA in lung tissue after mild COVID-19. Lancet Respir. Med. 9, e78–e79 (2021).
Gaebler, C. et al. Evolution of antibody immunity to SARS-CoV-2. Nature 591, 639–644 (2021).
Menuchin-Lasowski, Y. et al. SARS-CoV-2 infects and replicates in photoreceptor and retinal ganglion cells of human retinal organoids. Stem Cell Rep 17, 789–803 (2022).
Cheung, C. C. L. et al. Residual SARS-CoV-2 viral antigens detected in GI and hepatic tissues from five recovered patients with COVID-19. Gut 71, 226–229 (2022).
Natarajan, A. et al. Gastrointestinal symptoms and fecal shedding of SARS-CoV-2 RNA suggest prolonged gastrointestinal infection. Med 3, 371–387.e9 (2022).
Katsoularis, I. et al. Risks of deep vein thrombosis, pulmonary embolism, and bleeding after covid-19: nationwide self-controlled cases series and matched cohort study. BMJ 377, e069590 (2022).
Pretorius, E. et al. Persistent clotting protein pathology in Long COVID/post-acute sequelae of COVID-19 (PASC) is accompanied by increased levels of antiplasmin. Cardiovasc. Diabetol. 20, 172 (2021).
Kubánková, M. et al. Physical phenotype of blood cells is altered in COVID-19. Biophys. J. 120, 2838–2847 (2021).
Osiaevi, I. et al. Persistent capillary rarefication in long COVID syndrome. Angiogenesis https://doi.org/10.1007/s10456-022-09850-9 (2022).
Patel, M. A. et al. Elevated vascular transformation blood biomarkers in long-COVID indicate angiogenesis as a key pathophysiological mechanism. Mol. Med. 28, 122 (2022).
Puntmann, V. O. et al. Outcomes of cardiovascular magnetic resonance imaging in patients recently recovered from coronavirus disease 2019 (COVID-19). JAMA Cardiol 5, 1265–1273 (2020).
Roca-Fernández, A. et al. Cardiac impairment in Long Covid 1-year post-SARS-CoV-2 infection. Eur. Heart J. 43, ehac544.219 (2022).
Dennis, A. et al. Multiorgan impairment in low-risk individuals with post-COVID-19 syndrome: a prospective, community-based study. BMJ Open 11, e048391 (2021).
Dennis, A. et al. Multi-organ impairment and Long COVID: a 1-year prospective, longitudinal cohort study. Preprint at medRxiv https://doi.org/10.1101/2022.03.18.22272607 (2022).
Bowe, B., Xie, Y., Xu, E. & Al-Aly, Z. Kidney outcomes in Long COVID. J. Am. Soc. Nephrol. 32, 2851–2862 (2021).
Almufarrij, I. & Munro, K. J. One year on: an updated systematic review of SARS-CoV-2, COVID-19 and audio-vestibular symptoms. Int. J. Audiol. 60, 935–945 (2021).
Holdsworth, D. A. et al. Comprehensive clinical assessment identifies specific neurocognitive deficits in working-age patients with long-COVID. PLoS ONE 17, e0267392 (2022).
Cysique, L. A. et al. Post-acute COVID-19 cognitive impairment and decline uniquely associate with kynurenine pathway activation: a longitudinal observational study. Preprint at medRxiv https://doi.org/10.1101/2022.06.07.22276020 (2022).
Crivelli, L. et al. Changes in cognitive functioning after COVID-19: a systematic review and meta-analysis. Alzheimers Dement. 18, 1047–1066 (2022).
Woo, M. S. et al. Frequent neurocognitive deficits after recovery from mild COVID-19. Brain Commun. 2, fcaa205 (2020).
Taquet, M. et al. Neurological and psychiatric risk trajectories after SARS-CoV-2 infection: an analysis of 2-year retrospective cohort studies including 1 284 437 patients. Lancet Psychiatry 9, 815–827 (2022).
Reiken, S. et al. Alzheimer’s-like signaling in brains of COVID-19 patients. Alzheimers Dement. 18, 955–965 (2022).
Charnley, M. et al. Neurotoxic amyloidogenic peptides in the proteome of SARS-COV2: potential implications for neurological symptoms in COVID-19. Nat. Commun. 13, 3387 (2022).
Visser, D. et al. Long COVID is associated with extensive in-vivo neuroinflammation on [18F]DPA-714 PET. Preprint at medRxiv https://doi.org/10.1101/2022.06.02.22275916 (2022).
Guedj, E. et al. 18F-FDG brain PET hypometabolism in patients with long COVID. Eur. J. Nucl. Med. Mol. Imaging 48, 2823–2833 (2021).
Hugon, J. et al. Cognitive decline and brainstem hypometabolism in long COVID: a case series. Brain Behav. 12, e2513 (2022).
Apple, A. C. et al. Risk factors and abnormal cerebrospinal fluid associate with cognitive symptoms after mild COVID-19. Ann. Clin. Transl Neurol. 9, 221–226 (2022).
Douaud, G. et al. SARS-CoV-2 is associated with changes in brain structure in UK Biobank. Nature 604, 697–707 (2022).
Peluso, M. J. et al. SARS-CoV-2 and mitochondrial proteins in neural-derived exosomes of COVID-19. Ann. Neurol. 91, 772–781 (2022).
Villaume, W. A. Marginal BH4 deficiencies, iNOS, and self-perpetuating oxidative stress in post-acute sequelae of Covid-19. Med. Hypotheses 163, 110842 (2022).
Bitirgen, G. et al. Corneal confocal microscopy identifies corneal nerve fibre loss and increased dendritic cells in patients with long COVID. Br. J. Ophthalmol. https://doi.org/10.1136/bjophthalmol-2021-319450 (2021).
Barros, A. et al. Small fiber neuropathy in the cornea of Covid-19 patients associated with the generation of ocular surface disease. Ocul. Surf. 23, 40–48 (2022).
Bitirgen, G. et al. Abnormal quantitative pupillary light responses following COVID-19. Int. Ophthalmol. https://doi.org/10.1007/s10792-022-02275-9 (2022).
Mardin, C. Y. et al. Possible impact of functional active GPCR-autoantibodies on retinal microcirculation in long-COVID. Invest. Ophthalmol. Vis. Sci. 63, 3315–F0124 (2022).
Zhang, B.-Z. et al. SARS-CoV-2 infects human neural progenitor cells and brain organoids. Cell Res. 30, 928–931 (2020).
Sen, S. et al. Retinal manifestations in patients with SARS-CoV-2 infection and pathogenetic implications: a systematic review. Int. Ophthalmol. 42, 323–336 (2022).
Frere, J. J. et al. SARS-CoV-2 infection in hamsters and humans results in lasting and unique systemic perturbations post recovery. Sci. Transl Med. 14, eabq3059 (2022).
Rutkai, I. et al. Neuropathology and virus in brain of SARS-CoV-2 infected non-human primates. Nat. Commun. 13, 1745 (2022).
Committee on the Diagnostic Criteria for Myalgic Encephalomyelitis/Chronic Fatigue Syndrome, Board on the Health of Select Populations, & Institute of Medicine. Beyond Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: Redefining an Illness (National Academies Press, 2015).
Bateman, L. et al. Myalgic encephalomyelitis/chronic fatigue syndrome: essentials of diagnosis and management. Mayo Clin. Proc. 96, 2861–2878 (2021).
The ME Association. Index of ME/CFS published research - Nov 2022. 224 Index of ME/CFS Published Research. The ME Association https://meassociation.org.uk/ (2022).
Seltzer, J. & Thomas, J. ME Research Summary 2019 (The ME Association, 2019).
Wong, T. L. & Weitzer, D. J. Long COVID and myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS)-a systemic review and comparison of clinical presentation and symptomatology. Med. (Kaunas.) 57, 418 (2021).
Twomey, R. et al. Chronic fatigue and postexertional malaise in people living with Long COVID: an observational study. Phys. Ther. 102, pzac005 (2022).
Vernon, S. D. et al. Orthostatic challenge causes distinctive symptomatic, hemodynamic and cognitive responses in Long COVID and myalgic encephalomyelitis/chronic fatigue syndrome. Front. Med. 9, 917019 (2022).
Lam, M. H.-B. et al. Mental morbidities and chronic fatigue in severe acute respiratory syndrome survivors: long-term follow-up. Arch. Intern. Med. 169, 2142–2147 (2009).
Keller, B. A., Pryor, J. L. & Giloteaux, L. Inability of myalgic encephalomyelitis/chronic fatigue syndrome patients to reproduce VO2peak indicates functional impairment. J. Transl Med. 12, 104 (2014).
Saha, A. K. et al. Erythrocyte deformability as a potential biomarker for chronic fatigue syndrome. Blood 132, 4874 (2018).
Díaz-Resendiz, K. J. G. et al. Loss of mitochondrial membrane potential (ΔΨm) in leucocytes as post-COVID-19 sequelae. J. Leukoc. Biol. 112, 23–29 (2022).
Pozzi, A. COVID-19 and mitochondrial non-coding RNAs: new insights from published data. Front. Physiol. 12, 805005 (2022).
Guntur, V. P. et al. Signatures of mitochondrial dysfunction and impaired fatty acid metabolism in plasma of patients with post-acute sequelae of COVID-19 (PASC). Metabolites 12, 1026 (2022).
Paul, B. D., Lemle, M. D., Komaroff, A. L. & Snyder, S. H. Redox imbalance links COVID-19 and myalgic encephalomyelitis/chronic fatigue syndrome. Proc. Natl Acad. Sci. USA 118, e2024358118 (2021).
Wright, J., Astill, S. L. & Sivan, M. The relationship between physical activity and Long COVID: a cross-sectional study. Int. J. Environ. Res. Public Health 19, 5093 (2022).
Heerdt, P. M., Shelley, B. & Singh, I. Impaired systemic oxygen extraction long after mild COVID-19: potential perioperative implications. Br. J. Anaesth. 128, e246–e249 (2022).
Novak, P. et al. Multisystem involvement in post-acute sequelae of coronavirus disease 19. Ann. Neurol. 91, 367–379 (2022).
Holmes, E. et al. Incomplete systemic recovery and metabolic phenoreversion in post-acute-phase nonhospitalized COVID-19 patients: implications for assessment of post-acute COVID-19 syndrome. J. Proteome Res. 20, 3315–3329 (2021).
van Campen, C. L. M. C. & Visser, F. C. Orthostatic intolerance in long-haul COVID after SARS-CoV-2: a case-control comparison with post-EBV and insidious-onset myalgic encephalomyelitis/chronic fatigue syndrome patients. Healthcare 10, 2058 (2022).
van Campen, C. L. M. C. & Visser, F. C. Long-Haul COVID patients: prevalence of POTS are reduced but cerebral blood flow abnormalities remain abnormal with longer disease duration. Healthcare 10, 2105 (2022).
Nunes, J. M., Kruger, A., Proal, A., Kell, D. B. & Pretorius, E. The occurrence of hyperactivated platelets and fibrinaloid microclots in myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS). Pharmaceuticals 15, 931 (2022).
Hoad, A., Spickett, G., Elliott, J. & Newton, J. Postural orthostatic tachycardia syndrome is an under-recognized condition in chronic fatigue syndrome. QJM 101, 961–965 (2008).
Shaw, B. H. et al. The face of postural tachycardia syndrome – insights from a large cross‐sectional online community‐based survey. J. Intern. Med. 286, 438–448 (2019).
Raj, S. R. et al. Postural orthostatic tachycardia syndrome (POTS): priorities for POTS care and research from a 2019 National Institutes of Health expert consensus meeting - part 2. Auton. Neurosci. Basic. Clin. 235, 102836 (2021).
Oaklander, A. L. et al. Peripheral neuropathy evaluations of patients with prolonged Long COVID. Neurol. Neuroimmunol. Neuroinflamm. 9, e1146 (2022).
Larsen, N. W. et al. Characterization of autonomic symptom burden in long COVID: a global survey of 2,314 adults. Front. Neurol. 13, 1012668 (2022).
Weinstock, L. B. et al. Mast cell activation symptoms are prevalent in Long-COVID. Int. J. Infect. Dis. 112, 217–226 (2021).
Boneva, R. S. et al. Endometriosis as a comorbid condition in chronic fatigue syndrome (CFS): secondary analysis of data from a CFS case-control study. Front. Pediatr. 7, 195 (2019).
Bragée, B. et al. Signs of intracranial hypertension, hypermobility, and craniocervical obstructions in patients with myalgic encephalomyelitis/chronic fatigue syndrome. Front. Neurol. 11, (2020).
Medina-Perucha, L. et al. Self-reported menstrual alterations during the COVID-19 syndemic in Spain: a cross-sectional study. Int. J. Womens Health 14, 529–544 (2022).
Ding, T. et al. Analysis of ovarian injury associated with COVID-19 disease in reproductive-aged women in Wuhan, China: an observational study. Front. Med. 8, 635255 (2021).
Sharp, G. C. et al. The COVID-19 pandemic and the menstrual cycle: research gaps and opportunities. Int. J. Epidemiol. https://doi.org/10.1093/ije/dyab239 (2021).
Khan, S. M. et al. SARS-CoV-2 infection and subsequent changes in the menstrual cycle among participants in the Arizona CoVHORT study. Am. J. Obstet. Gynecol. 226, 270–273 (2022).
Harlow, B. L., Signorello, L. B., Hall, J. E., Dailey, C. & Komaroff, A. L. Reproductive correlates of chronic fatigue syndrome. Am. J. Med. 105, 94S–99S (1998).
Thomas, N., Gurvich, C., Huang, K., Gooley, P. R. & Armstrong, C. W. The underlying sex differences in neuroendocrine adaptations relevant to myalgic encephalomyelitis chronic fatigue syndrome. Front. Neuroendocrinol. 66, 100995 (2022).
Boneva, R. S., Lin, J.-M. S. & Unger, E. R. Early menopause and other gynecologic risk indicators for chronic fatigue syndrome in women. Menopause 22, 826–834 (2015).
Kresch, E. et al. COVID-19 endothelial dysfunction can cause erectile dysfunction: histopathological, immunohistochemical, and ultrastructural study of the human penis. World J. Mens Health 39, 466–469 (2021).
Maleki, B. H. & Tartibian, B. COVID-19 and male reproductive function: a prospective, longitudinal cohort study. Reproduction 161, 319–331 (2021).
Yu, J. Z. et al. Lung perfusion disturbances in nonhospitalized post-COVID with dyspnea — a magnetic resonance imaging feasibility study. J. Intern. Med. 292, 941–956 (2022).
Cho, J. L. et al. Quantitative chest CT assessment of small airways disease in post-acute SARS-CoV-2 infection. Radiology 304, 185–192 (2022).
Vijayakumar, B. et al. Immuno-proteomic profiling reveals aberrant immune cell regulation in the airways of individuals with ongoing post-COVID-19 respiratory disease. Immunity 55, 542–556.e5 (2022).
Littlefield, K. M. et al. SARS-CoV-2-specific T cells associate with inflammation and reduced lung function in pulmonary post-acute sequalae of SARS-CoV-2. PLOS Pathog. 18, e1010359 (2022).
Meringer, H. & Mehandru, S. Gastrointestinal post-acute COVID-19 syndrome. Nat. Rev. Gastroenterol. Hepatol. 19, 345–346 (2022).
König, R. S. et al. The gut microbiome in myalgic encephalomyelitis (ME)/chronic fatigue syndrome (CFS). Front. Immunol. 12, 628741 (2022).
Zuo, T. et al. Depicting SARS-CoV-2 faecal viral activity in association with gut microbiota composition in patients with COVID-19. Gut 70, 276–284 (2021).
Zollner, A. et al. Postacute COVID-19 is characterized by gut viral antigen persistence in inflammatory bowel diseases. Gastroenterology 163, 495–506.e8 (2022).
Giron, L. B. et al. Markers of fungal translocation are elevated during post-acute sequelae of SARS-CoV-2 and induce NF-κB signaling. JCI Insight https://doi.org/10.1172/jci.insight.160989 (2022).
Jason, L. A. et al. COVID-19 symptoms over time: comparing long-haulers to ME/CFS. Fatigue Biomed. Health Behav. 9, 59–68 (2021).
Tran, V.-T., Porcher, R., Pane, I. & Ravaud, P. Course of post COVID-19 disease symptoms over time in the ComPaRe long COVID prospective e-cohort. Nat. Commun. 13, 1812 (2022).
Walker, A., Kelly, C., Pottinger, G. & Hopkins, C. Parosmia — a common consequence of covid-19. BMJ 377, e069860 (2022).
Jamal, S. M. et al. Prospective evaluation of autonomic dysfunction in post-acute sequela of COVID-19. J. Am. Coll. Cardiol. 79, 2325–2330 (2022).
Stavileci, B., Özdemir, E., Özdemir, B., Ereren, E. & Cengiz, M. De-novo development of fragmented QRS during a six-month follow-up period in patients with COVID-19 disease and its cardiac effects. J. Electrocardiol. 72, 44–48 (2022).
Grist, J. T. et al. Lung abnormalities depicted with hyperpolarized 129Xe MRI in patients with long COVID. Radiology 305, 709–717 (2022).
US ME/CFS Clinician Coalition. Testing Recommendations for Suspected ME/CFS (US ME/CFS Clinician Coalition, 2021).
Galán, M. et al. Persistent overactive cytotoxic immune response in a Spanish cohort of individuals with long-COVID: identification of diagnostic biomarkers. Front. Immunol. 13, 848886 (2022).
Grandjean, D. et al. Screening for SARS-CoV-2 persistence in Long COVID patients using sniffer dogs and scents from axillary sweats samples. Clin. Trials 12, 2 (2022).
Pifarré, F. et al. The use of oxygen as a possible screening biomarker for the diagnosis of chronic fatigue. Apunt. Sports Med 57, 100379 (2022).
Jason, L. A., Kalns, J., Richarte, A., Katz, B. Z. & Torres, C. Saliva fatigue biomarker index as a marker for severe myalgic encephalomyelitis/chronic fatigue syndrome in a community based sample. Fatigue Biomed. Health Behav. 9, 189–195 (2021).
Esfandyarpour, R., Kashi, A., Nemat-Gorgani, M., Wilhelmy, J. & Davis, R. W. A nanoelectronics-blood-based diagnostic biomarker for myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS). Proc. Natl Acad. Sci. USA 116, 10250–10257 (2019).
Nkiliza, A. et al. Sex-specific plasma lipid profiles of ME/CFS patients and their association with pain, fatigue, and cognitive symptoms. J. Transl Med. 19, 370 (2021).
Bolton, M. J., Chapman, B. P. & Van Marwijk, H. Low-dose naltrexone as a treatment for chronic fatigue syndrome. BMJ Case Rep. 13, e232502 (2020).
Pitt, B., Tate, A. M., Gluck, D., Rosenson, R. S. & Goonewardena, S. N. Repurposing low-dose naltrexone (LDN) for the prevention and treatment of immunothrombosis in COVID-19. Eur. Heart J. Cardiovasc. Pharmacother. https://doi.org/10.1093/ehjcvp/pvac014 (2022).
Alper, K. Case report: famotidine for neuropsychiatric symptoms in COVID-19. Front. Med. 7, 614393 (2020).
Hohberger, B. et al. Case report: neutralization of autoantibodies targeting G-protein-coupled receptors improves capillary impairment and fatigue symptoms after COVID-19 infection. Front. Med. 8, 754667 (2021).
Wang, C. et al. Long COVID: the nature of thrombotic sequelae determines the necessity of early anticoagulation. Front. Cell. Infect. Microbiol. 12, 861703 (2022).
The ME Association. A new treatment for Long Covid? The ME Association https://meassociation.org.uk/2021/10/a-new-treatment-for-long-covid/ (2021).
Tölle, M. et al. Myalgic encephalomyelitis/chronic fatigue syndrome: efficacy of repeat immunoadsorption. J. Clin. Med. 9, E2443 (2020).
Wood, E., Hall, K. H. & Tate, W. Role of mitochondria, oxidative stress and the response to antioxidants in myalgic encephalomyelitis/chronic fatigue syndrome: a possible approach to SARS-CoV-2 ‘long-haulers’? Chronic Dis. Transl Med. 7, 14–26 (2020).
NICE. Myalgic encephalomyelitis (or encephalopathy)/chronic fatigue syndrome: diagnosis and management. NICE https://www.nice.org.uk/guidance/NG206 (2021).
World Health Organization. Support for Rehabilitation Self-Management After COVID-19 Related Illness (WHO, 2021).
CDC. Treatment of ME/CFS | Myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS). CDC https://www.cdc.gov/me-cfs/treatment/index.html (2021).
Long COVID Physio. Exercise. Long COVID Physio https://longcovid.physio/exercise (2022).
Geng, L. N., Bonilla, H. F., Shafer, R. W., Miglis, M. G. & Yang, P. C. Case report of breakthrough long COVID and the use of nirmatrelvir-ritonavir. Preprint at https://www.researchsquare.com/article/rs-1443341/v1 (2022).
Xie, Y., Choi, T. & Al-Aly, Z. Nirmatrelvir and the risk of post-acute sequelae of COVID-19. Preprint at medRxiv https://doi.org/10.1101/2022.11.03.22281783 (2022).
Charfeddine, S. et al. Sulodexide in the treatment of patients with long COVID 19 symptoms and endothelial dysfunction: the results of TUN-EndCOV study. Arch. Cardiovasc. Dis. Suppl. 14, 127 (2022).
Thomas, R. et al. A randomised, double-blind, placebo-controlled trial evaluating concentrated phytochemical-rich nutritional capsule in addition to a probiotic capsule on clinical outcomes among individuals with COVID-19 — the UK Phyto-V study. COVID 2, 433–449 (2022).
Zhang, L. et al. Gut microbiota-derived synbiotic formula (SIM01) as a novel adjuvant therapy for COVID-19: an open-label pilot study. J. Gastroenterol. Hepatol. 37, 823–831 (2022).
Liu, L. D. & Duricka, D. L. Stellate ganglion block reduces symptoms of Long COVID: a case series. J. Neuroimmunol. 362, 577784 (2022).
Belcaro, G. et al. Preventive effects of Pycnogenol® on cardiovascular risk factors (including endothelial function) and microcirculation in subjects recovering from coronavirus disease 2019 (COVID-19). Minerva Med. 113, 300–308 (2022).
Crooks, V., Waller, S., Smith, T. & Hahn, T. J. The use of the Karnofsky Performance Scale in determining outcomes and risk in geriatric outpatients. J. Gerontol. 46, M139–M144 (1991).
Ledford, H. Long-COVID treatments: why the world is still waiting. Nature 608, 258–260 (2022).
Toogood, P. L., Clauw, D. J., Phadke, S. & Hoffman, D. Myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS): where will the drugs come from? Pharmacol. Res. 165, 105465 (2021).
US ME/CFS Clinician Coalition. ME/CFS Treatment Recommendations (US ME/CFS Clinician Coalition, 2021).
Taquet, M., Dercon, Q. & Harrison, P. J. Six-month sequelae of post-vaccination SARS-CoV-2 infection: a retrospective cohort study of 10,024 breakthrough infections. Brain Behav. Immun. 103, 154–162 (2022).
Office for National Statistics. Self-reported long COVID after infection with the Omicron variant in the UK: 6 May 2022. Office for National Statistics https://www.ons.gov.uk/peoplepopulationandcommunity/healthandsocialcare/conditionsanddiseases/bulletins/selfreportedlongcovidafterinfectionwiththeomicronvariant/6may2022 (2022).
Tsuchida, T. et al. Relationship between changes in symptoms and antibody titers after a single vaccination in patients with Long COVID. J. Med. Virol. 94, 3416–3420 (2022).
VA COVID-19 Observational Research Collaboratory. Burden of PCR-confirmed SARS-CoV-2 reinfection in the U.S. Veterans Administration, March 2020 – January 2022. Preprint at medRxiv https://doi.org/10.1101/2022.03.20.22272571 (2022).
Bowe, B., Xie, Y. & Al-Aly, Z. Acute and postacute sequelae associated with SARS-CoV-2 reinfection. Nat. Med. https://doi.org/10.1038/s41591-022-02051-3 (2022).
Blomberg, J., Gottfries, C.-G., Elfaitouri, A., Rizwan, M. & Rosén, A. Infection elicited autoimmunity and myalgic encephalomyelitis/chronic fatigue syndrome: an explanatory model. Front. Immunol. 9, 229 (2018).
Cauchemez, S. & Bosetti, P. A reconstruction of early cryptic COVID spread. Nature 600, 40–41 (2021).
CDC. Estimated COVID-19 burden. Centers for Disease Control and Prevention https://www.cdc.gov/coronavirus/2019-ncov/cases-updates/burden.html (2020).
Kucirka, L. M., Lauer, S. A., Laeyendecker, O., Boon, D. & Lessler, J. Variation in false-negative rate of reverse transcriptase polymerase chain reaction–based SARS-CoV-2 tests by time since exposure. Ann. Intern. Med. 173, 262–267 (2020).
Levine-Tiefenbrun, M. et al. SARS-CoV-2 RT-qPCR test detection rates are associated with patient age, sex, and time since diagnosis. J. Mol. Diagn. 24, 112–119 (2022).
Jarvis, K. F. & Kelley, J. B. Temporal dynamics of viral load and false negative rate influence the levels of testing necessary to combat COVID-19 spread. Sci. Rep. 11, 9221 (2021).
Dattner, I. et al. The role of children in the spread of COVID-19: using household data from Bnei Brak, Israel, to estimate the relative susceptibility and infectivity of children. PLoS Comput. Biol. 17, e1008559 (2021).
Langeland, N. & Cox, R. J. Are low SARS-CoV-2 viral loads in infected children missed by RT-PCR testing? Lancet Reg. Health Eur. 5, 100138 (2021).
Van Elslande, J. et al. Longitudinal follow-up of IgG anti-nucleocapsid antibodies in SARS-CoV-2 infected patients up to eight months after infection. J. Clin. Virol. 136, 104765 (2021).
Liu, W. et al. Predictors of nonseroconversion after SARS-CoV-2 infection. Emerg. Infect. Dis. 27, 2454–2458 (2021).
Toh, Z. Q. et al. Comparison of seroconversion in children and adults with mild COVID-19. JAMA Netw. Open 5, e221313 (2022).
Peterson, T. M., Peterson, T. W., Emerson, S., Meredyth, A. Evans, E. R. & Jason, L. A. Coverage of CFS within U.S. medical schools. Univers. J. Public Health 1, 177–179 (2013).
Rowe, P. C. et al. Orthostatic intolerance and chronic fatigue syndrome associated with Ehlers-Danlos syndrome. J. Pediatr. 135, 494–499 (1999).
Nguyen, T. et al. Novel characterisation of mast cell phenotypes from peripheral blood mononuclear cells in chronic fatigue syndrome/myalgic encephalomyelitis patients. Asian Pac. J. Allergy Immunol. 35, 75–81 (2017).
Wagner, C., Isenmann, S., Ringendahl, H. & Haensch, C.-A. Anxiety in patients with postural tachycardia syndrome (POTS). Fortschr. Neurol. Psychiatr. 80, 458–462 (2012).
Grayson, D. A., Mackinnon, A., Jorm, A. F., Creasey, H. & Broe, G. A. Item bias in the center for epidemiologic studies depression scale: effects of physical disorders and disability in an elderly community sample. J. Gerontol. Ser. B 55, P273–P282 (2000).
Twisk, F. N. M. & Maes, M. A review on cognitive behavorial therapy (CBT) and graded exercise therapy (GET) in myalgic encephalomyelitis (ME) / chronic fatigue syndrome (CFS): CBT/GET is not only ineffective and not evidence-based, but also potentially harmful for many patients with ME/CFS. Neuro Endocrinol. Lett. 30, 284–299 (2009).
Vink, M. & Vink-Niese, F. Is it useful to question the recovery behaviour of patients with ME/CFS or Long COVID? Healthcare 10, 392 (2022).
Dysautonomia International. What is dysautonomia? Dysautonomia International http://www.dysautonomiainternational.org/page.php?ID=34 (2022).
CDC. Epidemiology | Presentation and clinical course | Healthcare providers | Myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS). CDC https://www.cdc.gov/me-cfs/healthcare-providers/presentation-clinical-course/epidemiology.html (2021).
Sørensen, A. I. V. et al. A nationwide questionnaire study of post-acute symptoms and health problems after SARS-CoV-2 infection in Denmark. Nat. Commun. 13, 4213 (2022).
Berg, S. K. et al. Long COVID symptoms in SARS-CoV-2-positive children aged 0–14 years and matched controls in Denmark (LongCOVIDKidsDK): a national, cross-sectional study. Lancet Child Adolesc. Health 6, 614–623 (2022).
Morrow, A. K. et al. Long-term COVID 19 sequelae in adolescents: the overlap with orthostatic intolerance and ME/CFS. Curr. Pediatr. Rep. 10, 31–44 (2022).
Cooper, S. et al. Long COVID-19 liver manifestation in children. J. Pediatr. Gastroenterol. Nutr. https://doi.org/10.1097/MPG.0000000000003521 (2022).
Kompaniyets, L. Post–COVID-19 symptoms and conditions among children and adolescents — United States, March 1, 2020–January 31, 2022. MMWR Morb. Mortal. Wkly Rep. 71, 993–999 (2022).
Edlow, A. G., Castro, V. M., Shook, L. L., Kaimal, A. J. & Perlis, R. H. Neurodevelopmental outcomes at 1 year in infants of mothers who tested positive for SARS-CoV-2 during pregnancy. JAMA Netw. Open 5, e2215787 (2022).
Morand, A. et al. Similar patterns of [18F]-FDG brain PET hypometabolism in paediatric and adult patients with long COVID: a paediatric case series. Eur. J. Nucl. Med. Mol. Imaging 49, 913–920 (2022).
Heiss, R. et al. Pulmonary dysfunction after pediatric COVID-19. Radiology https://doi.org/10.1148/radiol.221250 (2022).
Remerciements
Nous tenons à remercier la longue communauté de patients et de chercheurs sur le COVID Long et les pathologies associées, ainsi que toute l'équipe du Patient-Led Research Collaborative. E.J.T. a bénéficié de la subvention UL1TR002550 du National Center for Advancing Translational Sciences (NCATS).